(BO du MEDAD n° 2007/12 du 30 juin 2007)
NOR : DEVO0700215C La ministre de lécologie et du développement durable à Mesdames et Messieurs les préfets coordonnateurs de bassin ; Mesdames et Messieurs les préfets de région ; Mesdames et Messieurs les préfets de département.
Pièces jointes : protocole de prélèvement et de traitement des échantillons des invertébrés sur le réseau de contrôle de surveillance et ses annexes.
PLAN DE DIFFUSION |
POUR EXÉCUTION
Destinataires | POUR INFORMATION
Destinataires |
| Préfets coordonnateurs de bassin | DIREN |
| Préfets de région | Agences de leau |
| Préfets de département (MISE) | Offices de leau
CSP/ONEMA
CEMAGREF |
En application de la directive 2000/60/CE du 23 octobre 2000 du Parlement et du Conseil établissant un cadre pour une politique communautaire dans le domaine de leau, un programme de surveillance est mis en place sur les différentes catégories deau. Pour les cours deau, lélément de qualité biologique « invertébrés » est à suivre selon les principes énoncés dans la circulaire DCE 2006/16 relative à la constitution et la mise en oeuvre du programme de surveillance (contrôle de surveillance, contrôles opérationnels, contrôles denquête et contrôles additionnels) pour les eaux douces de surface (cours deau, canaux et plans deau).
Lobjet du présent document est de préciser le protocole de prélèvement et de traitement des échantillons des invertébrés à mettre en oeuvre pour le contrôle de surveillance sur cours deau.
Vous voudrez bien me faire part des difficultés que vous pourriez rencontrer dans lapplication de la présente circulaire.
Pour la ministre et par délégation :
Le directeur de leau,
P. BERTEAUD
Protocole de prélèvement et de traitement des échantillons des invertébrés sur le réseau de contrôle de surveillance
Philippe Usseglio-Polatera, université de Metz.
Jean-Gabriel Wasson & Virginie Archaimbault, Cemagref Lyon.
Appui scientifique à la mise en oeuvre de la directive-cadre européenne sur leau note méthodologique du 30 mars 2007.
I. Objectifs et principes généraux
I.1. Objets et définitions
La présente note concerne uniquement les macro-invertébrés dans les cours deau. Elle a pour objet de proposer un nouveau protocole de prélèvement et de traitement des échantillons pour le réseau de contrôle de surveillance, dans le cadre de la mise en oeuvre de la directive-cadre européenne sur leau (DCE).
Le protocole proposé sapplique aux cours deau dont la totalité ou la quasi-totalité des habitats présents dans le lit mouillé peuvent être prospectés en période de basses eaux, à pied ou au moyen dembarcations légères, avec des appareils à main de type filet Surber (1).
On entend par station une portion de cours deau représentative de lhydro-morphologie dun tronçon en termes de diversité des habitats physiques, y compris les éventuelles altérations hydro-morphologiques.
Un échantillon correspond à lensemble des n prélèvements unitaires dinvertébrés réalisés sur une station à une date donnée (n = 8 pour le protocole IBGN, et n = 12 pour le présent protocole).
On entend par habitat la combinaison dun substrat (ou support) et dune classe de vitesse de courant.
(1) Correspond aux classes TP, P et M, et une partie de la classe G de la typologie nationale. Une version du protocole adaptée aux grands cours deau sera proposée ultérieurement.
I.2. Objectifs
La plupart des méthodes utilisées au niveau européen préconisent un prélèvement représentatif des principaux habitats présents sur une station (i.e. réalisé au prorata de leurs surfaces de recouvrement relatives), de façon à obtenir une image globale moyenne du peuplement dinvertébrés.
Cependant, certaines méthodes diffèrent quant à la prise en compte des habitats marginaux en terme de superficie.
Ainsi le protocole AQEM (2) ne considère pas les habitats qui représentent moins de 5 % de la mosaïque benthique. Largument avancé, assis sur de nombreuses données, est que léchantillonnage dhabitats marginaux résiduels peut masquer leffet des altérations physiques même dans des cours deaux dont les caractéristiques hydro-morphologiques sont très fortement dégradées.
Mais avec un protocole de type AQEM, des habitats peu représentés, qui abritent cependant une faune spécifique (e.g. chevelus racinaires, litières, bryophytes), peuvent ne pas être échantillonnés. Or cette faune est souvent très informative sur létat écologique dune station, notamment sur les premiers signes dune altération. A linverse, lIBGN favorise léchantillonnage des habitats marginaux au détriment dune bonne représentation des habitats dominants, ce qui induit souvent un biais important dans la représentativité de la faune par léchantillon réalisé, et peut masquer leffet de certaines altérations.
Le but du présent protocole est donc de combiner les avantages de ces deux approches tout en réduisant leurs inconvénients, en réalisant un échantillonnage séparé des habitats dominants et marginaux. Il répond à trois objectifs principaux :
fournir une image représentative du peuplement dinvertébrés dune station, mais en séparant la faune des habitats dominants et des habitats marginaux ;
permettre le développement et la mise en oeuvre dun nouvel indice multi-métrique dévaluation de létat écologique à partir des invertébrés pour les réseaux de surveillance, qui soit à la fois conforme aux exigences de la DCE et en meilleure cohérence avec les différentes méthodes utilisées au niveau européen ;
permettre néanmoins le calcul, avec une marge dincertitude acceptable, de la note IBGN (norme NF T-90350, AFNOR, 1992, 2004) qui restera la méthode officielle dévaluation de létat écologique pendant une période transitoire, jusquà ladoption du nouvel indice ; ceci permettra en outre de garantir la continuité du suivi et de continuer à valoriser les chroniques acquises depuis 1992.
En outre lélaboration de cette future méthode doit répondre à deux contraintes pratiques :
ne requérir quune augmentation raisonnablement limitée du coût par rapport à lIBGN ;
rester compatible avec le protocole mis en oeuvre sur le réseau de référence, qui servira à déterminer les valeurs de référence pour le nouvel indice.
Le protocole appliqué sur les réseaux de référence répondait déjà à ces objectifs, mais avec un niveau de précision et de contrainte supérieur, notamment pour le recalcul de la note IBGN. Le protocole « réseau de surveillance » tient compte de lexpérience acquise par les praticiens sur le réseau de référence, et des difficultés apparues lors de la mise en oeuvre du protocole correspondant. Le protocole « réseau de surveillance » est donc directement dérivé du protocole appliqué sur le réseau de référence, avec un certain nombre de simplifications et dallègements méthodologiques portant sur :
le protocole de terrain (prélèvement des échantillons) ;
le protocole de laboratoire (traitement des échantillons) ;
le niveau taxonomique (détermination des invertébrés).
(2) Site web AQEM : http://www.aqem.de. Pré-norme CEN : cf. document CEN/TC 230 N 0503 Guidance on pro-rata Multi-Habitat-Sampling of Benthic invertebrates from wadeable rivers).
I.3. Principes généraux
Pour obtenir un échantillon représentatif de la mosaïque des habitats dominants dun site donné, et échantillonner les habitats marginaux qui permettront en outre de calculer une note IBGN, le présent protocole préconise déchantillonner 12 prélèvements en combinant :
un échantillonnage des habitats dominants basé sur 8 prélèvements unitaires ;
un échantillonnage des habitats marginaux, basé sur 4 prélèvements, qui permettra de garantir une conformité suffisante avec le protocole IBGN.
Les 12 prélèvements sont réalisés en 3 groupes de 4 relevés (ou 3 « bocaux ») qui pourront être regroupés sur le terrain en respectant certaines règles.
Dans la norme IBGN, comme dans le protocole AQEM, la prospection de substrats différents est nettement privilégiée. Cependant, la vitesse du courant est également un facteur important de diversification des peuplements dinvertébrés benthiques et doit être intégrée dans les règles déchantillonnage. On cherchera également à bien répartir les prélèvements sur lensemble de la station.
En pratique, cela signifie :
identifier sur le terrain les supports dominants (superficie > 5 %) et marginaux (< ou égal à 5 %) ;
réaliser un premier groupe de 4 prélèvements sur les supports marginaux, suivant lordre dhabitabilité (bocal 1) ;
réaliser un deuxième groupe de 4 prélèvements sur les supports dominants, suivant lordre dhabitabilité (bocal 2) ;
réaliser un troisième groupe de 4 prélèvements sur les supports dominants, en privilégiant la représentativité des habitats (bocal 3).
Les résultats seront exprimés sous la forme de 3 listes faunistiques par échantillon, soit une liste pour chaque bocal. Ces listes permettront par différentes combinaisons de recalculer
une liste « équivalente IBGN » (B1 + B2) ;
une liste « habitats dominants » (B2 + B3) ;
une liste « habitats marginaux » (B1) ;
une liste « faune globale » (B1 + B2 + B3).
Ce protocole permettra donc dinclure dans le futur indice des métriques calculées séparément sur la faune des habitats dominants et marginaux et sur la faune globale, et de calculer une note dindice « équivalent IBGN » (3).
(3) Lincertitude sur le calcul de lIBGN sera évaluée à laide des données détaillées sur 12 prélèvements acquises sur les sites de référence.
II. Préparation de léchantillonnage
II.1. Choix des stations
Pour être représentative de la morphologie dun tronçon de cours deau, la station sera calée préférentiellement sur des séquences de faciès radier/mouille. La largeur du lit à plein bord (notée Lpb) est une grandeur de calage en géométrie hydraulique qui permet de prévoir statistiquement la longueur moyenne des séquences de faciès. En première approximation, cette largeur peut être estimée rapidement sur le terrain à partir de la zone non végétalisée du lit. La longueur dune séquence radier/mouille représente en moyenne 6 fois la largeur du lit à plein bord.
Pour les cours deaux de petite et moyenne dimension (classes P et M de la typologie nationale), 2 séquences radier/mouille seront considérées, soit 12* Lpb.
Pour les très petits cours deaux (classe TP), souvent plus hétérogènes, il est préférable de prendre en compte
3 séquences (soit 18* Lpb).
Pour les grands cours deaux (classe G), le choix de 2 séquences reste préférable, mais il sera parfois nécessaire pour des raisons pratiques de se limiter à une séquence (soit 6* Lpb), en prenant soin de la choisir la plus représentative possible de la morphologie moyenne du tronçon.
Quelle que soit la taille du cours deau la station devra être aussi représentative que possible de la morphologie du tronçon, y compris des éventuelles altérations hydro-morphologiques.
Les éléments pratiques nécessaires à la mise en oeuvre sur le terrain sont détaillés en annexe I.
II.2. Positionnement des stations
Le repérage et le positionnement de la station sont à réaliser une seule fois pour chaque station, sauf événement hydrologique majeur bouleversant la morphologie du lit. En pratique, il est fortement recommandé de réaliser ce repérage avant la première campagne de prélèvement.
La démarche décrite ci-dessous devra être respectée pour le choix de lemplacement précis de chaque station :
1. Estimer visuellement la largeur à plein bord Lpb.
2. Repérer visuellement sur une longueur suffisante (environ 5 à 8 séquences, soit 30 à 50 Lpb en fonction de la taille ducours deau), les conditions morpho-dynamiques du secteur.
Pour les grands cours deau, cette étape pourra utilement être préparée en utilisant des photos aériennes (orthophotoplan au 1/25 000 par exemple).
3. Choisir les séquences contiguës les plus représentatives, en prenant soin déviter dy inclure des singularités morphologiques.
On entend par singularités des structures naturelles ou artificielles isolées, qui ne se retrouvent pas de manière répétitive et régulière sur le tronçon (au moins sur le secteur repéré visuellement), par exemple : ponts, protections de berges très localisées, embâcles isolés, affluents, faciès ou substrats aux caractéristiques particulières.
4. Mesurer la largeur moyenne à plein bord, sur une dizaine de transects espacés denviron 1,5 fois la largeur estimée (4). Cette valeur, mesurée avec une précision de ± 5 %, sera notée Lpb.
5. Choisir et calculer la longueur totale de la station (12, 18 ou 6 Lpb selon les cas) qui sera notée Lt, en mètres.
6. Positionner une première limite de station (amont ou aval), sur une limite de faciès caractéristique, par exemple la tête dun radier.
7. Se déplacer dune longueur de station le long du cours deau, en prenant soin didentifier les limites des principaux faciès : radiers, plats, mouilles (5).
8. Positionner la deuxième limite de station sur la structure équivalente à celle choisie comme première limite (ex : tête de radier) la plus proche de la distance calculée.
9. Si les limites de faciès ne sont pas repérables (cas des rivières très lentes ou chenalisées), on prendra dans tous les cas une station de la longueur calculée, en calant la première limite sur un repère visible.
Il est impératif de noter avec précision des repères, ou de baliser les limites choisies, ou dutiliser des coordonnées GPS précises, de manière à retrouver facilement la station lors des campagnes ultérieures.
(4) Voir annexe I. Il est fortement recommandé dutiliser pour cette opération un télémètre.
(5) Voir annexe I pour lidentification des faciès.
II.3. Identification des stations
Chaque station sera identifiée très précisément par les informations suivantes :
code station (précédé du code bassin, au format RNB) ;
nom du cours deau ;
nom de la station ;
nom et code INSEE de la commune ;
altitude ;
largeur du lit à plein bord ;
longueur totale de la station ;
latitude et longitude (GPS) des points limites amont et aval (6).
Ces informations sont à renseigner selon les indications fournies dans les fiches de lannexe II.
(6) En cas dimpossibilité dutiliser un GPS (vallées encaissées), fournir une photocopie de la carte IGN au 1/25 000 avec la position de la station.
II.4. Dates des campagnes de prélèvement
La circulaire DCE 2006/16 relative à la constitution et la mise en oeuvre du programme de surveillance préconise pour le réseau de contrôle de surveillance une campagne déchantillonnage par an, pour chaque année.
En règle générale, pour les cours deau à régime pluvial et ne présentant pas de variation saisonnière marquée des altérations chimiques et hydrologiques, la campagne sera réalisée en période de basses eaux. Au sein de cette période, les dates réelles des prélèvements devront être adaptées aux grandes écorégions, en distinguant notamment les sites suivant leur distribution altitudinale, de façon à tenir compte des différences dans les rythmes biologiques.
Dans les cours deaux à régime nival ou glaciaire avec de forts débits au printemps et en été, la campagne pourra être avancée de façon à précéder la fonte des neiges.
Les prélèvements ne doivent pas être réalisés dans les conditions suivantes :
turbidité anormale ne permettant pas de décrire la mosaïque dhabitats ;
après un épisode de forte crue ayant entraîné un remaniement généralisé du substrat ; dans ce cas un délai de recolonisation est recommandé.
III. Protocole de prélèvement sur le terrain
III.1. Appareils de prélèvements
Les 12 prélèvements de 1/20 de mètres carrés sont réalisés comme dans la norme IBGN actuelle au filet Surber (0,5 millimètre de vide de maille) ou au filet troubleau en fonction de laccessibilité des substrats (ou supports).
Les détails du protocole de prélèvement par type dhabitat sont proposés avec la définition de chaque substrat.
III.2. Définition des habitats
III.2.1. Définition des substrats
Un substrat est constitué par une association déléments minéraux (pouvant inclure des éléments organiques), ou déléments végétaux, présentant des caractères physiques homogènes sur une certaine surface.
Pour être pris en compte dans la description de la station et inclus dans léchantillonnage, un substrat doit représenter une surface minimale au moins égale à un pour mille de la surface de la station ; cette surface est estimée visuellement.
Cette surface minimale doit être contiguë pour les substrats minéraux, définis daprès la classe granulométrique qui présente la plus forte proportion apparente en surface.
En revanche, cette surface minimale peut ne pas être contiguë pour les substrats non minéraux.
La surface minimale contiguë pour inclure un substrat dans léchantillonnage est celle dun Surber (1/20 de mètre carré) sauf pour les bryophytes (voir tableau I).
Tableau I : Surfaces minimales nécessaires indicatives pour la prise en compte dun type de substrat dans le plan déchantillonnage en fonction de la taille du cours deau
| LARGEUR DU COURS DEAU (en m) | SURFACE MINIMALE DUN SUBSTRAT (en m2) | SURFACE MINIMALE DÉCHANTILLONNAGE |
| 2 à 8 TP | 0,05 à 0,75 | Surface du filet Surber 1/20 m2 (contiguë sauf bryophytes) |
| 8 à 15 P | 0,75 à 2,5 | Surface du filet Surber 1/20 m2 (contiguë sauf bryophytes) |
| 15 à 25 M | 2,5 à 7,5 | Surface du filet Surber 1/20 m2 (contiguë sauf bryophytes) |
| 25 à 40 G | 7,5 à 10 | Surface du filet Surber 1/20 m2 (contiguë sauf bryophytes) |
| > 40 TG | > 10 | Surface du filet Surber 1/20 m2 (contiguë sauf bryophytes) |
Les différents types de substrat, classés comme dans lIBGN selon un ordre de priorité déchantillonnage correspondant à une habitabilité décroissante, sont précisés dans le tableau II.
Tableau II : Définition et ordre déchantillonnage des substrats
| DÉFINITION DU SUBSTRAT | HABITABILITÉ | PROTOCOLE PRÉLÈVEMENT |
| Bryophytes | 11 | Végétal seul (sur bloc) ou avec élément support (sur cailloux) |
| Spermaphytes immergés (hydrophytes) | 10 | Inclut la couche superficielle du sédiment |
| Débris organiques grossiers (litières) | 9 | Inclut la couche superficielle du sédiment |
| Chevelus racinaires, supports ligneux | 8 | Végétal seul |
| Sédiments minéraux de grande taille (pierres, galets) (25 à 250 mm) | 7 | Inclut les différentes classes granulométriques de sédiments |
| Blocs (> 250 mm) inclus dans une matrice déléments minéraux de grande taille (25 à 250 mm) | 6 | Inclut les sédiments et la faune associés au bloc (abris sous bloc) |
| Granulats grossiers (graviers) (2 à 25 mm) | 5 | Inclut les différentes classes granulométriques de sédiments |
| Spermaphytes émergents de strate basse (hélophytes) | 4 | Inclut la couche superficielle du sédiment |
| Vases : sédiments fins (< 0,1 mm) avec débris organiques fins | 3 | Couche superficielle du sédiment (< 3 cm) |
| Sables et limons (< 2 mm) | 2 | Couche superficielle du sédiment (< 3 cm) |
| Algues | 1 | Inclut les éléments minéraux du support |
| Surfaces uniformes dures naturelles et artificielles (roches, dalles, marnes et argiles compactes) | 0 | Raclage de surface |
III.2.2. Protocole de prélèvement détaillé pour chaque type de substrat
La méthode consiste à ramener dans le Surber, à la main, une partie du substrat, y compris fin (petits cailloux à vase), ce qui signifie que la méthode des « coups de pied » (e.g. associée au kick-sampling) est à proscrire.
Le filet du Surber doit être vidé entre chaque prélèvement unitaire.
Bryophytes :
Placer le Surber à contre-courant sur les bryophytes, et frotter et peigner énergiquement pendant au moins 10 secondes sur toute la surface du cadre. Sur les blocs, néchantillonner que le végétal.
Si la surface des bryophytes nest pas suffisante pour remplir le cadre du Surber, il est possible de faire le prélèvement en plusieurs points jusquà avoir la surface déchantillonnage requise.
Si les bryophytes sont peu représentées, sur les pierres, considérer alors le support principal comme pierre et les bryophytes sont à renseigner dans les cases « nature végétation » et « abondance végétation » de la fiche de terrain.
Spermaphytes immergés (hydrophytes) :
Placer le Surber à contre-courant sur les hydrophytes, prélever la totalité du végétal contenu dans le cadre de 1/20 mètres carrés. Dans la pratique, on introduit le végétal dans le filet et on le coupe.
Les végétaux adhérant au substrat (ex : callitriches) sont prélevés avec la couche superficielle du substrat. Pour les spermaphytes enracinés dont une partie de lappareil végétatif est flottante (ex : renoncules), seul le végétal est prélevé.
Si un seul prélèvement doit être réalisé dans les hydrophytes, il est réalisé sur lespèce dominante en superficie.
Si plusieurs prélèvements doivent être réalisés dans les hydrophytes dans une même classe de vitesse, ils sont réalisés si possible sur les différentes espèces présentes dans lordre décroissant de leur surface relative.
Débris organiques grossiers (litières) :
Placer le Surber à contre-courant sur la surface à échantillonner. Racler la surface du sédiment correspondant à lintérieur du cadre sur une épaisseur permettant de prélever un volume final compris entre 0,5 et 1 l au maximum.
Chevelus racinaires, substrats ligneux :
Faites glisser le Surber à contre-courant sur les racines. Frotter et peigner énergiquement les racines pendant au moins 10 secondes de façon à récupérer les individus dans le filet.
Sédiments minéraux de grande taille (pierres, galets) (25 à 250 millimètres) :
Placer le Surber à contre-courant sur la zone à échantillonner. Soulever les pierres et galets se trouvant à lintérieur du cadre et bien les frotter in situ pour récupérer tous les organismes fixés (au besoin terminer cette opération sur la rive). Prélever également la couche sous les pierres et galets jusquà un maximum de 5 centimètres.
Blocs (> 250 millimètres) inclus dans une matrice déléments minéraux de grande taille (25 à 250 millimètres) :
Placer le Surber à contre-courant en aval du bloc. Soulever le bloc et prélever la partie sous-bloc, bien frotter le bloc pour récupérer tous les organismes fixés dessus.
Granulats grossiers :
Placer le Surber à contre-courant sur la zone à échantillonner. Prendre les graviers se trouvant à lintérieur du cadre et bien les frotter pour récupérer les organismes fixés. Prélever jusquà un maximum de 5 centimètres.
Spermaphytes émergents de strate basse (hélophytes) :
Placer le Surber à contre-courant sur la base des hélophytes. Frotter la base des hélophytes avec la main sur une surface équivalente à lintérieur du cadre.
Vases : sédiments fins (< 0,1 millimètre) avec débris organiques fins :
Placer le Surber à contre-courant sur la zone à échantillonner. Prélever à la main les 3 premiers centimètres du substrat ou une épaisseur permettant de prélever un volume final compris entre 0,5 et 1 litre au maximum.
Sil ny a pas assez de courant, lopérateur doit créer un courant deau pour favoriser la récolte du sédiment et des organismes présents dans le cadre délimité par le filet Surber.
Sables et limons (< 2 millimètres) :
Placer le Surber à contre-courant sur la zone à échantillonner. Prélever à la main les 3 premiers centimètres du substrat ou une épaisseur permettant de prélever un volume final compris entre 0,5 et 1 litre au maximum.
Sil ny a pas assez de courant, lopérateur doit créer un courant deau pour favoriser la récolte du sédiment et des organismes présents dans le cadre délimité par le filet Surber.
Algues :
Placer le Surber à contre-courant sur la zone à échantillonner, échantillonner les algues avec leur support sousjacent.
Si les algues sont peu représentées, sur les pierres, considérer alors le support principal comme pierre et les algues sont à renseigner dans les cases « nature végétation » et « abondance végétation » de la fiche de terrain.
Surfaces uniformes dures naturelles et artificielles (roches, dalles, marnes et argiles compactes) :
Placer le Surber à contre-courant sur la zone à échantillonner. Frotter la surface du support.
III.2.3. Définition des classes de vitesses
Les classes de vitesses sont estimées à partir de la vitesse de surface exprimée en cm.s-1.
Tableau III : Définition des classes de vitesses
| CLASSE VITESSE (cm/s) | VITESSE | CODE SANDRE |
| v < 5 | Nulle | N1 |
| 25 > V > ou égal à 5 | Lente | N3 |
| 75 > V > ou égal à 25 | Moyenne | N5 |
| 150 > V > ou égal à 75 | Rapide | N4 |
III.2.4. Définition des substrats dominants et marginaux
On entend par substrat « dominant » un substrat qui représente plus de 5 % (> 5 %) de la surface mouillée totale de la station.
On entend par substrat « marginal » un substrat qui représente au maximum 5 % (< ou égal à 5 %) de la surface mouillée totale de la station. Cependant, pour être échantillonné, ce substrat doit constituer un habitat représentatif.
En pratique, cela signifie que la présence de ce substrat ne doit pas être exceptionnelle, ou liée à une singularité morphologique. Un habitat marginal peut être lié à la configuration du lit (zones étroites de bordures), généré par la dynamique fluviale (petits dépôts sableux ou vaseux, accumulations de débris organiques grossiers...), ou par des structures artificielles (e.g. protections de berges localisées). Mais pour être représentatif du cours deau, ce type dhabitat doit se retrouver de manière régulière et répétitive le long du secteur que la station est supposée représenter.
La taille minimale dun substrat marginal est de 1 pour mille de la surface de la station (voir Tableau I), cette surface est estimée visuellement et peut ne pas être contiguë pour les substrats non minéraux.
III.3. Conduite de léchantillonnage
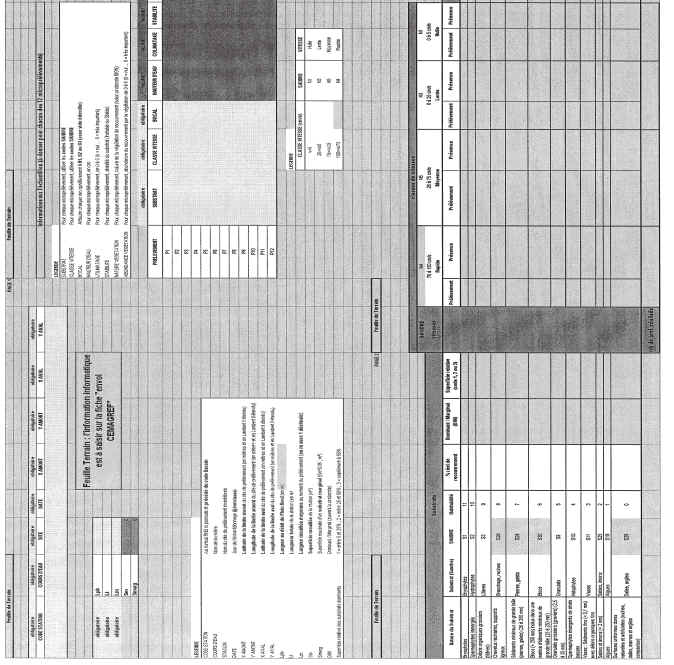
Léchantillonnage doit être précédé dun repérage des habitats marginaux et dominants à échantillonner, qui sont indiqués sur « la fiche terrain » (Annexe II).
Lopérateur peut alors définir son plan déchantillonnage (i.e. les 3 combinaisons de 4 substrats quil devra prélever pour constituer les 3 bocaux).
Ensuite, les prélèvements sont réalisés en trois phases (dont lordre reste au choix du préleveur) :
Phase 1 : échantillonnage des habitats marginaux représentatifs (bocal 1) ;
Phase 2 : échantillonnage des habitats dominants, avec priorité au substrat (bocal 2) ;
Phase 3 : échantillonnage complémentaire des habitats dominants, au prorata des superficies (bocal 3).
III.3.1. Repérage des substrats dominants et marginaux
La première étape sur le terrain lors de chaque campagne de prélèvement consistera à estimer la superficie mouillée de la station, puis à identifier les substrats marginaux représentatifs et les substrats dominants, et à évaluer la superficie relative de ces substrats.
a) Estimation de la superficie mouillée
La longueur totale de la station (notée Lt, en mètres) est supposée connue dès le repérage de la station (cf. II.2, alinéa 5). On calculera la largeur mouillée moyenne à partir de la mesure, avec une précision de ± 5 % (7), dune dizaine de transects régulièrement espacés sur la station. Cette largeur mouillée est notée Lm (en mètres, avec une décimale).
La superficie mouillée, calculée par le produit {Lt * Lm}, est estimée en m2 et notée Sm.
(7) Lusage dun télémètre laser est recommandé.
b) Identification des substrats marginaux représentatifs
La superficie maximale dun substrat marginal représentatif (Smarg) est égale à 5 % de la superficie mouillée totale de la station, soit {Sm * 0,05}. Cette superficie sentend en cumulant la superficie de lensemble des zones où ce substrat est présent sur la station.
Les différents substrats marginaux représentatifs sont identifiés, et leur présence est notée sur la feuille déchantillonnage par la lettre M dans la colonne « Dominants/Marginaux ».
La superficie relative (en %) de ces substrats marginaux est estimée visuellement, et notée en % de la surface totale de la station sur la feuille de terrain (colonne « Superficie relative »)
Les différentes classes de vitesses dans lesquelles ces substrats sont rencontrés sont notées par des croix (X) dans les colonnes correspondantes.
c) Identification des substrats dominants
Les différents substrats dominants présents sur la station (superficie totale de chaque support > 5 % de la surface mouillée) sont notés sur la feuille déchantillonnage par la lettre D dans la colonne « Dominants/Marginaux ».
La superficie relative (%) de ces substrats dominants est estimée visuellement, et notée en % de la surface totale de la station sur la feuille de terrain, colonne « Superficie relative » (la somme des superficies relatives des substrats dominants et marginaux doit être égale à 100 %).
La superficie relative (%) des substrats dominants est également codée en 3 catégories (colonne « code 1, 2 ou 3 ») de la manière suivante :
D 3 pour les substrats occupant plus de 50 % de la superficie totale de la station ;
D 2 pour les substrats occupant plus de 25 % et au maximum 50 % de la superficie totale ;
D1 pour les substrats occupant plus de 5 % et au maximum 25 % de la superficie totale.
Les différentes classes de vitesse dans lesquelles ces substrats sont rencontrés sont notées par des croix (X) dans les colonnes correspondantes.
III.3.2. Echantillonnage des habitats marginaux
Phase 1 Échantillonnage des habitats marginaux représentatifs
Dans cette phase, les substrats marginaux sont échantillonnés, avec 4 prélèvements unitaires, réalisés dans lordre des substrats du tableau II. Ils constitueront le « bocal 1 ».
Si plus de 4 substrats marginaux ont été identifiés, seuls les 4 premiers dans lordre du tableau II sont échantillonnés.
Chaque substrat est échantillonné dans la classe de vitesse la plus représentée pour ce substrat.
Si 3 substrats marginaux seulement ont été identifiés, le 4e prélèvement est effectué sur le substrat marginal présentant la plus grande superficie, en faisant varier, si possible, la classe de vitesse.
Si 2 substrats marginaux seulement ont été identifiés, les 2 prélèvements restants sont effectués sur ces deux substrats, en faisant varier, si possible, les classes de vitesse.
Si un seul substrat marginal a été identifié, les 4 prélèvements sont effectués sur ce même substrat, dans des placettes différentes, en faisant varier si possible les classes de vitesse.
Si aucun substrat na été identifié comme marginal, on considère comme habitat marginal les zones de bordure en vitesse lente ou nulle ; 4 prélèvements seront effectués dans ces habitats pour garantir une superficie totale prélevée constante.
III.3.3. Echantillonnage des habitats dominants
Positionnement des prélèvements dans la station
Lors des deux phases suivantes, lopérateur sefforcera de répartir les prélèvements sur lensemble de la station, de manière à assurer une représentation adéquate des différents faciès. Lorsquun même substrat doit être prélevé plusieurs fois, les prélèvements seront dispersés sur lensemble des faciès où ce substrat est présent.
Afin de bien représenter la diversité des habitats lors de léchantillonnage, lorsque différentes configurations sont possibles, on cherchera à positionner des prélèvements dans les différentes classes de vitesse représentées sur la station.
Léchantillonnage des substrats dominants est réalisé en 2 phases (phases 2 et 3) décrites ci-après.
A la fin des phases 2 et 3, chaque classe de vitesse identifiée sur les substrats dominants devra être représentée par au moins un prélèvement.
A la fin des phases 2 et 3, lensemble des substrats dominants (parmi les 8 premiers du tableau II) devrait normalement être représenté par un minimum de :
3 prélèvements sur les substrats occupant plus de 50 % de la superficie totale (codés D 3) ;
2 prélèvements sur les substrats occupant plus de 25 % et au maximum 50 % de la superficie totale (codés D 2) ;
1 prélèvement sur les substrats occupant plus de 5 % et au maximum 25 % de la superficie totale (codés D 1).
Phase 2 Échantillonnage des habitats dominants, avec priorité au substrat
Au cours de cette phase, 4 prélèvements unitaires sont réalisés sur les 4 premiers substrats dominants dans lordre du tableau II. Ils constitueront le « bocal 2 ».
Si plus de 4 substrats dominants ont été identifiés, seuls les 4 premiers dans lordre du tableau II sont échantillonnés. Chaque substrat est échantillonné dans la classe de vitesse la plus représentée pour ce substrat.
Si 3 substrats dominants seulement ont été identifiés, le 4e prélèvement est effectué sur le substrat présentant la plus grande superficie, en faisant varier, si possible, la classe de vitesse par ordre de représentativité.
Si 2 substrats dominants seulement ont été identifiés :
si ces deux substrats ont une superficie relative > 25 % (classe D 2 et D 3), 2 prélèvements sont effectués sur chaque substrat, en faisant varier, si possible, les classes de vitesse par ordre de représentativité ;
si un des deux substrats a une superficie relative < 25 % (classe D 1), un seul prélèvement est effectué sur ce substrat, et les 3 autres sur le substrat présentant la plus grande superficie, en faisant varier, si possible, la classe de vitesse par ordre de représentativité.
Si un seul substrat dominant a été identifié, les 4 prélèvements sont effectués sur ce même substrat en faisant varier, si possible, les classes de vitesse par ordre de représentativité.
Phase 3 : Echantillonnage complémentaire des habitats dominants au prorata des superficies
Au cours de cette phase, les 4 prélèvements unitaires seront répartis de manière à compléter léchantillonnage des habitats dominants au prorata de leur superficie, à partir des règles suivantes. Ils constitueront le « bocal 3 ».
Si plus de 4 substrats dominants ont été identifiés, les substrats non échantillonnés au cours de la phase 2 seront échantillonnés dans lordre décroissant de leur superficie relative, dans la classe de vitesse la plus représentée pour chaque substrat.
Lorsque tous les substrats dominants ont été échantillonnés au moins une fois au cours des phases 2 et 3, les prélèvements restant à effectuer sont positionnés sur les substrats déjà échantillonnés, au prorata de leur superficie relative, en faisant varier autant que possible les classes de vitesse par ordre de représentativité.
III.3.4. Renseignement de la feuille déchantillonnage
Sur la feuille déchantillonnage, les différentes combinaisons substrat/vitesse correspondant aux prélèvements regroupés dans les trois bocaux doivent être intégralement renseignées.
Les numéros des prélèvements (P 1 à P 12) seront notés au cours de léchantillonnage dans la case correspondant à lhabitat échantillonné (« fiche terrain », annexe II : intersection du substrat et de la classe de vitesse).
Ces informations seront ensuite reportées dans le tableau correspondant de la « fiche envoi CEMAGREF » (annexe II).
III.3.5. Regroupement des prélèvements
Pour chacune des 3 phases, les prélèvements de même nature peuvent être regroupés physiquement, sur le terrain, dans un même récipient soigneusement étiqueté avec le numéro du bocal correspondant, en respectant les règles suivantes :
les différents substrats minéraux dun même bocal (blocs, pierres, galets, graviers, sables) sont regroupés ;
pour tous les autres types de substrats, seuls les substrats de nature similaire prélevés au cours de la même phase (correspondant à un même bocal) sont regroupés.
Dans tous les cas, les différents récipients doivent être soigneusement étiquetés avec la mention du bocal auquel ils appartiennent.
III.3.6. Traitement et fixation des échantillons sur le terrain
Un premier traitement sur le terrain est recommandé pour concentrer les prélèvements, et éliminer les éléments minéraux et organiques grossiers qui peuvent endommager les organismes durant le transport.
Les éléments grossiers sont soigneusement examinés et lavés au-dessus dun tamis de maille identique à celle des appareils de prélèvement (0,5 mm).
Les organismes fragiles (e.g. éphéméroptères, triclades) peuvent être fixés à lalcool et mis dans un récipient séparé, étiqueté avec le numéro du bocal.
Les gros individus despèces rares ou protégées (e.g. écrevisses indigènes [Astacus austropotamobius], moules [Margaritiferidae, unionidae], libellules [Cordulegaster], Perlidae, Ephemeridae]), seront de préférence identifiés et comptés sur le terrain, puis remis à leau.
Le mode de conservation des échantillons reste au choix du laboratoire (8). Le formaldéhyde (concentration finale 4 %), léthanol (concentration finale 70 %) peuvent être employés. Pour des raisons de sécurité, le conservateur utilisé doit être indiqué sur le récipient.
(8) Lusage de la congélation demande le suivi dun protocole très strict (température et délai de conservation avant congélation, conditions de décongélation, estimation des pertes de certains taxons) qui doit être précisé.
IV. Traitement des échantillons au laboratoire
IV.1. Limites de détermination taxonomique
Les limites retenues tiennent compte à la fois :
de linformation bio-écologique supplémentaire apportée par une identification au genre par rapport à la famille et
de la difficulté didentification dun taxon à un niveau systématique plus précis. Le gain dinformation bioécologique a été estimé à partir du calcul de la diversité bio-écologique des différents genres à lintérieur dune même famille. Cette diversité a été calculée en fonction de la distribution de ces genres au sein de groupes fonctionnels définis sur la base des caractéristiques biologiques et/ou écologiques des organismes (9).
La difficulté didentification des familles au niveau du genre a été codée après une enquête menée auprès des DIREN. Le couplage de ces deux sources dinformation permet de définir une liste faunistique « finie ».
La liste des niveaux taxonomiques requis est fournie dans le tableau IV.
Louvrage de base pour la détermination est le guide « Invertébrés deau douce Systématique, biologie, écologie » (10). Cet ouvrage sera complété par la note additive à louvrage « Introduction à létude des macroinvertébrés des eaux douces » (11) pour les taxons nouveaux ou invasifs.
La détermination se fera au niveau requis, sauf pour les individus trop abîmés ou correspondant aux premiers stades larvaires, qui seront identifiés à la famille.
La liste finie des taxons à référencer avec leur niveau didentification est détaillée dans lannexe III.
(9) Usseglio-Polatera P., M. Bournaud, P. Richoux & H. Tachet. 2000. Biological and Ecological Traits of Benthic Freshwater Macroinvertebrates : Relationships and Definition of Groups with Similar Traits. Freshwater Biology 43 : 175-205. Usseglio-Polatera P., P. Richoux, M. Bournaud & H. Tachet. 2001. A Functional Classification of Benthic Macroinvertebrates Based on Biological and Ecological Traits : Application to River Condition Assessment and Stream Management. Archiv für Hydrobiologie Suppl. 139 : 53-83.
(10) Tachet, H., P. Richoux, M. Bournaud & P. Usseglio-Polatera, 2000. Invertébrés deau douce. Systématique, biologie, écologie. Paris, CNRS Editions.
(11) Tachet H., Bournaud M. & P. Richoux. Introduction à létude des macro-invertébrés des eaux douces. Systématique élémentaire et aperçu écologique. Supplément de mise à jour 2006. Ce fascicule peut être commandé à lAssociation française de limnologie (2,50 euros).
Tableau IV : Niveaux didentification requis pour les différents groupes taxonomiques
| TAXONS | NIVEAU SYSTÉMATIQUE |
| Plecoptera | Genre |
| Ephemeroptera | Genre |
| Trichoptera (sauf Limnephilidae) | Genre |
| Trichoptera limnephilidae | Sous-famille |
| Coleoptera (sauf Dytiscidae, Hydrophilidae et Curculionidae) | Genre |
| Coleoptera (Dytiscidae, Hydrophilidae) | Sous-famille |
| Coleoptera curculionidae | Famille |
| Megaloptera | Genre |
| Heteroptera (sauf Corixinae) | Famille |
| Heteroptera corixinae | Sous-famille |
| Planipennia | Genre |
| Odonata (sauf Coenagrionidae) | Genre |
| Odonata coenagrionidae | Famille |
| Lepidoptera | Famille |
| Hymenoptera | Genre |
| Diptera | Famille |
| (Hydr)acarina | PRESENCE |
| Crustacea (sauf Asellidae) | Genre |
| Crustacea asellidae | Famille |
| Bivalvia | Genre |
| Gastropoda (sauf Planorbidae) | Genre |
| Gastropoda planorbidae | Famille |
| Hirudinea et Branchiobdellida | Famille |
| Oligochaeta | Classe |
| Bryozoa | PRESENCE |
| Nematoda | PRESENCE |
| Gordiacea | PRESENCE |
| Turbellaria | Famille |
| Hydrozoa | PRESENCE |
| Porifera | PRESENCE |
| Nemertea | PRESENCE |
IV.2. Tri et quantification des prélèvements
Le protocole de tri sapplique à chaque « bocal » regroupant les 4 prélèvements effectués au cours de chacune des trois phases de terrain. Les prélèvements de chaque bocal peuvent être ramenés au laboratoire dans un ou plusieurs récipients selon les cas (cf. § III.3.5).
Le but est dobtenir pour chaque bocal une liste faunistique quantifiée, avec des abondances par taxon, selon le niveau taxonomique requis (tableau IV).
IV.2.1. Estimation de labondance
Labondance est le nombre dindividus estimé, par taxon, pour lensemble des 4 prélèvements du même bocal, soit 1/5 de mètre carré. Les taxons pour lesquels une indication de « présence » est uniquement demandée (tableau IV) ne doivent pas être dénombrés.
Le dénombrement des individus est réalisé au niveau taxonomique de la famille. La précision requise pour lestimation de labondance de chaque famille est de lordre de _ 25 %. Le dénombrement exhaustif des individus pour les taxons abondants nest pas nécessaire ; dans ce cas, lutilisation du sous-échantillonnage est fortement recommandée. Différentes techniques de sous-échantillonnage sont applicables, au choix de lopérateur, en fonction du substrat à trier.
IV.2.2. Tri et quantification
La phase de tri et quantification comporte trois opérations :
les prélèvements ramenés du terrain sont dabord lavés sur une colonne de tamis ; la maille du tamis le plus fin est de 0,5 millimètre ;
sur les refus de tamis, les individus sont comptés au niveau taxonomique de la famille, directement ou à laide dune loupe monoculaire. Une technique de sous-échantillonnage peut être appliquée à cette opération ;
pour chaque taxon, un certain nombre dindividus doit être sorti pour identification et conservé pour un contrôle qualité ultérieur (cf. § IV.2.3).
IV.2.3. Identification et dénombrement
Pour tous les taxons dont lidentification est requise au niveau de la famille (ou présence attestée), au moins 10 individus (sils existent) sont sortis pour identification, et conservés.
Pour tous les taxons dont lidentification est requise au niveau du genre, à lintérieur de chaque famille, labondance des différents genres est estimée à partir de la détermination dun nombre limité dindividus. Ce nombre est fonction du nombre de genres existants dans cette famille. Le tableau de lannexe III indique pour chaque famille une diversité générique « faible » (2 à 3 genres) ou « forte » (4 genres ou plus).
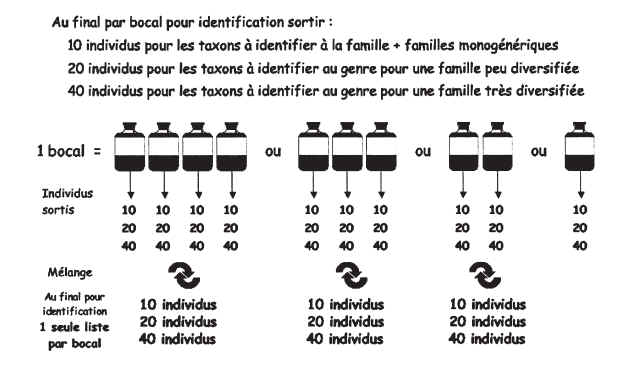
Pour chaque liste faunistique (= pour chaque bocal), le nombre minimum dindividus à identifier pour chaque famille est de :
10 individus pour les familles monogénériques ;
20 individus pour les familles à diversité générique « faible » (notées A dans lannexe III) ;
40 individus pour les familles à diversité générique « forte » (notées B dans lannexe III).
Lorsque différents prélèvements correspondant au même bocal ont été conservés séparément (dans différents récipients) lors des phases de terrain, ils sont triés et quantifiés séparément ; pour chaque famille, les individus sortis sont ensuite regroupés, et 20 ou 40 individus sont tirés au hasard pour identification (voir schéma annexe IV). Pour létablissement de la liste faunistique du bocal, les abondances de chaque taxon estimées dans les différents prélèvements sont simplement additionnées.
IV.3. Limitation du temps de tri et quantification
En pratique, la relation entre le temps passé au tri et le nombre de familles identifiées tend vers une asymptote, les premiers quarts dheure apportant le maximum dinformation. Pour les substrats minéraux, une demi-heure de tri pour un prélèvement unitaire permet dapporter une grande part de linformation (de lordre de 80 % de la richesse taxonomique) ; pour les autres types de substrats, cette durée est de lordre dune heure (12). Ces temps correspondent au travail dopérateurs expérimentés.
Afin doptimiser le rapport coût/information des échantillons, cette phase de tri et quantification sera donc réalisée dans un laps de temps limité en fonction de la nature du substrat.
Les temps de tri indiqués doivent permettre dextraire au minimum 80 % des taxons présents dans chaque bocal ou prélèvement.
Le tableau V indique les temps minimum et maximum requis pour le tri et la quantification de chaque « bocal » en fonction de la nature des substrats prélevés. Ces temps sappliquent à un opérateur expérimenté, et devront être majorés pour des stagiaires ou des débutants.
(12) Sur la base de résultats de tests réalisés en collaboration avec les DIREN Basse-Normandie, Haute-Normandie, Ile-de-France, Midi-Pyrénées, Lorraine, Nord - Pas-de-Calais, PACA, Rhône-Alpes, et le CEMAGREF Lyon.
Tableau V : Durées minimales et maximales requises pour la phase de tri, par bocal, en fonction de la nature des substrats prélevés, pour un opérateur expérimenté (hors temps de lavage)
| Nombre de prélèvements | Substrats minéraux | 4 | 3 | 2 | 1 | 0 |
| Autres substrats | 0 | 1 | 2 | 3 | 4 |
| Durée de tri en heures | Minimum | 1 | 1,5 | 2 | 2,5 | 3 |
| Maximum | 2 | 2,5 | 3 | 3,5 | 4 |
En fonction de la nature des prélèvements, le temps minimum de tri requis pour une station, pour un opérateur expérimenté ne peut être inférieur à 3 heures (uniquement si les 12 prélèvements sont constitués par des substrats minéraux), et le temps maximum ne devrait pas être supérieur à 12 heures.
Le tableau VI indique les temps minimum et maximum indicatifs pour le tri et la quantification dun seul prélèvement unitaire pour un type de substrat donné. Ces temps sappliquent à un opérateur expérimenté, et devront être majorés pour des stagiaires ou débutants.
La durée minimale du temps de tri par substrat correspond à la valeur moyenne permettant dobtenir 80 % de la richesse taxonomique du prélèvement considéré, obtenue à partir des données de temps de tri fournies par les DIREN. La durée maximale correspond à la moyenne plus lécart type.
Tableau VI : Durées minimales et maximales indicatives pour la phase de tri pour un seul prélèvement, en fonction de la nature du substrat prélevé, pour un opérateur expérimenté (hors temps de lavage)
| NATURE DU SUBSTRAT | DURÉE DE TRI MINIMUM | DURÉE DE TRI MAXIMUM |
| Bryophytes | 50 minutes | 1 h 20 |
| Spermaphytes immergés (hydrophytes) | 40 minutes | 1 h 05 |
| Débris organiques grossiers (litières) | 45 minutes | 1 h 05 |
| Chevelus racinaires, supports ligneux | 50 minutes | 1 h 05 |
| Sédiments minéraux de grande taille (pierres, galets) (25 à 250 mm) | 25 minutes | 45 minutes |
| Blocs (250 mm) inclus dans une matrice déléments minéraux de grande taille (25 à 250 mm) | 50 minutes | 1 h 30 |
| Granulats grossiers (graviers) (2 à 25 mm) | 40 minutes | 50 minutes |
| Spermaphytes émergents de strate basse (hélophytes) | 15 minutes | 20 minutes |
| Vases : sédiments fins (< 0,1 mm) avec débris organiques fins | 40 minutes | 1 h 00 |
| Sables et limons (< 2 mm) | 25 minutes | 35 minutes |
| Algues | 50 minutes | 1 h 25 |
| Surfaces uniformes dures naturelles et artificielles (roches, dalles, marnes et argiles compactes) | Non renseigné | Non renseigné |
Remarque : les temps de tri par bocal sont inférieurs à la somme des temps de tris des prélèvements séparés. Il est donc normal que la somme des temps (minimum et maximum) nécessaires pour le tri séparé de 12 prélèvements soit supérieure, par station, aux temps (minimum et maximum) requis dans le tableau V.
Il est impératif de noter le temps passé à trier léchantillon.
Annexe I : Aide au choix et au positionnement des stations de prélèvement
Principes de base
Le principe de base pour le positionnement des stations est que celles-ci soient représentatives de la diversité des habitats attendue, en conditions naturelles, à léchelle dun tronçon. Les habitats définis dans ce protocole comme la combinaison des substrats et vitesses découlement sont générés par des processus géomorphologiques.
Cest donc sur la base des caractéristiques morphologiques quil convient de repérer les stations. On trouvera dans louvrage « Impacts écologiques de la chenalisation des rivières » (i) une explication détaillée des principes qui justifient les règles de choix des stations. Nous résumons ci-après les principaux éléments.
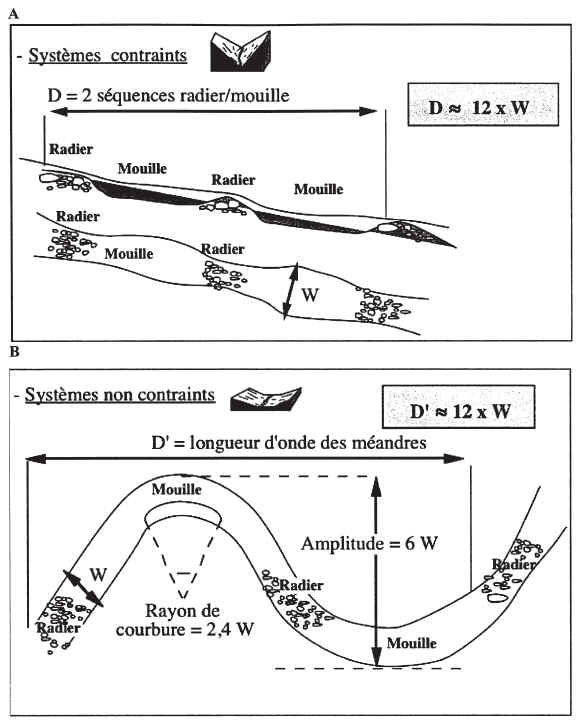
A léchelle dun tronçon de cours deau, dont la station se doit dêtre représentative, la diversité des habitats est déterminée par la succession des « faciès » morpho-dynamiques, qui sorganisent en « séquences ». La séquence universellement observée sur les cours deau est la succession de faciès à écoulement rapide ou « radiers » et à écoulement lent ou « mouilles » ; entre ces deux faciès sintercale très souvent un faciès de type « plat », à écoulement uniforme et de faible profondeur.
Les faciès sont générés par les épisodes de crues, lorsque lénergie de leau est suffisante pour mobiliser le substrat. Or cette énergie est maximale pour les débits dits « de plein bord », cest-à-dire juste avant que la rivière ne déborde ; en effet, lors des débordements, lénergie excédentaire qui se dissipe dans le lit majeur ne participe plus à la structuration du lit mineur. Le débit de plein bord (ou Qpb), qui correspond en moyenne à des crues de fréquence biennale (période de retour 1,5 à 2 ans, avec des variations locales dans la gamme de 0,5 à 5 ans) est pour cette raison considéré comme le débit « morphogène », celui qui structure les faciès du lit mineur. Le débit de plein bord est évidemment fortement corrélé à la largeur à plein bord (notée Lpb dans le protocole, ou W dans la littérature anglophone).
En conditions naturelles, les séquences de faciès se succèdent avec une périodicité remarquablement stable. En moyenne, la longueur dune séquence est de 6 fois la largeur plein bord (6*Lpb). Cette structure est illustrée dans la figure 1, pour des cours deaux correspondant à des contextes géomorphologiques différents : roche-mère dure (montagne) ou plaine alluviale.
Certaines séquences pouvant être « atypiques », on considère quun minimum de 2 séquences « radier mouille » est nécessaire pour assurer un minimum de représentativité des habitats (1) Comme indiqué dans le protocole (cf. § II.1), et pour des raisons pratiques, cette valeur pourra être adaptée en fonction de la largeur du cours deau, de 3 séquences pour les très petits cours deaux généralement plus hétérogènes, à une seule séquence pour les grands et très grands cours deau.
(1) En réalité, si lon recherchait une description précise des conditions hydro-morphologiques dun tronçon, une description de 5 séquences serait nécessaire pour obtenir des mesures statistiquement fiables.
Repérage de la largeur plein bord
Définir le débit de plein bord demande une évaluation précise de la hauteur limite de débordement, mais la largeur à plein bord est relativement aisée à évaluer ; rappelons ici que lincertitude acceptable de cette mesure pour le positionnement des stations est de lordre de 10 % (soit ± 5 %).
La largeur plein bord est celle du lit appelé généralement « lit moyen », qui est rempli et remanié lors des crues de fréquence annuelle à biennale (1 à 2 ans). Pour cette raison, une végétation pérenne ne peut généralement pas sy implanter. Le critère le plus simple pour repérer la largeur plein bord est donc la « zone non végétalisée » par une végétation pérenne (arbres et arbustes, plantes herbacées en formation dense), à lexclusion des plantes annuelles qui peuvent se développer en une saison sur les bancs de graviers.
En sus de ce critère simple, la forme des berges donne des repères complémentaires. Pour les berges redressées ou verticales, un repère à mi-hauteur est généralement suffisant. Pour les berges en pente douce, la limite du substrat mobile (graviers, sable, limons) récemment déposé fournit généralement un repère visible.
Dans certains cas particuliers, des critères supplémentaires doivent être utilisés.
Rivières à chenaux multiples : la largeur des bancs colonisés par une végétation pérenne assez ancienne (arbustes en formation dense, prairies installées) doit être soustraite de la largeur mesurée entre les berges situées en limite du lit majeur.
Rivières en tresses : les rivières à fort charriage, dans les zones de piedmont ou en région méditerranéenne, présentent des lits actifs très larges, dits « en tresses ». Ces lits sont fréquemment remaniés, et donc non végétalisés, parce que la rivière divague entre ses berges en déposant lexcès de charge minérale grossière provenant de bassins amonts pentus et érodables. Mais ils ne se remplissent pas entièrement deau pour les crues fréquentes.
La largeur plein bord à prendre en compte dans ce cas est celle dun chenal de crue bien marqué, dans les secteurs où lécoulement se concentre (rétrécissement de vallée, pont...). Cette largeur sera généralement très inférieure à celle du lit actif, mais correspond à celle du débit qui structure les principaux faciès.
Si aucune structure de ce type nest visible, on se calera sur les séquences de faciès les plus marquées du lit mineur pour délimiter la station ; la largeur plein bord sera alors estimée à 1/6 de la longueur moyenne dune séquence.
Rivières chenalisées : le but de la chenalisation étant de réduire les inondations, le débit de plein bord réel ne correspond plus au débit morphogène naturel, celui des crues fréquentes. Il faut donc estimer la largeur plein bord correspondant à une morphologie naturelle.
Ces rivières peuvent avoir un lit surdimensionné, et dans ce cas des atterrissements végétalisés se forment au pied des berges, témoignant du fait que la rivière se recrée un lit moyen correspondant à son débit morphogène.
La largeur plein bord est alors facile à déterminer daprès la limite végétation pérenne (souvent uniquement herbacée du fait de lentretien). Dans le cas inverse des lits fortement contraints, les berges redressées et les laisses de crues fréquentes permettent généralement une bonne approximation dune largeur plein bord naturelle.
Enfin, dans les rivières chenalisées, il arrive fréquemment que les faciès ne soient plus visibles. Dans ce cas, on prendra une longueur de station calée sur la largeur plein bord estimée (6, 12 ou 18 Lpb selon la taille cf. protocole § II.1), en se calant sur une structure repérable.
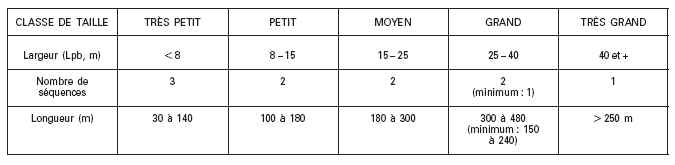
Valeurs moyennes de la largeur plein bord selon la taille du cours deau
Le tableau ci-dessous indique la gamme des largeurs plein bord attendue dans les différentes classes de taille de cours deau définies dans la typologie nationale. La fourchette correspondante des longueurs des stations, fonction du nombre de séquences de faciès à inclure, est donnée à titre de valeur repère.
Tableau 1 : Ordre de grandeur des largeurs plein bord et longueurs de station selon les classes de taille de la typologie nationale
Définition des faciès
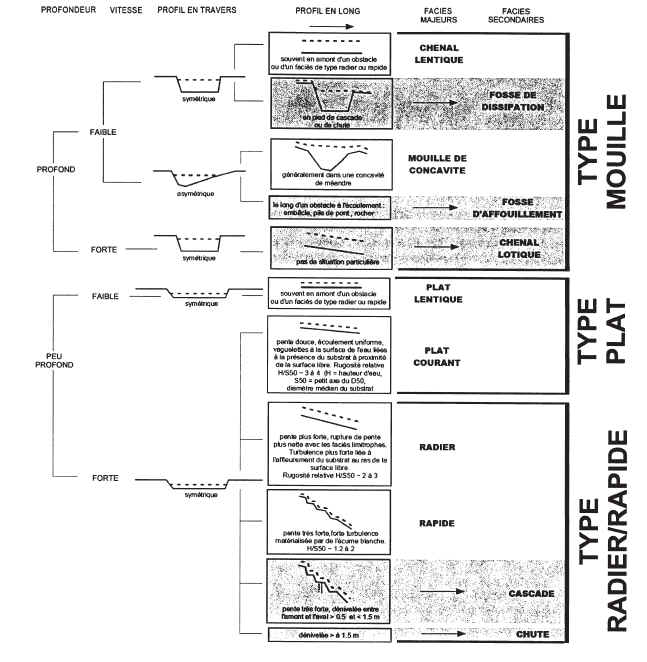
Pour le repérage des stations et le positionnement ultérieur des prélèvements, il est nécessaire de repérer les limites longitudinales des principaux types de faciès, « mouille », « plat » et « radiers ». Une note technique « Description standardisée des faciès découlement observables en rivière » (ii) donne des indications détaillées pour identifier ces faciès.
La clé de détermination ci-dessous (figure 2), extraite de cette note, a été modifiée pour la rendre applicable à une plus large gamme de classes de taille et de situations hydrologiques. Les six faciès majeurs sont séparés des faciès secondaires (en grisé), plus anecdotiques. De surcroît, les paramètres « profondeur » et « vitesses » sont décrits en valeur relative par rapport aux caractéristiques moyennes de la station. En première approximation, la limite entre les vitesses « faibles » et « fortes » pourra être fixée à 25 30 cm/s ; la différence entre les zones profondes et peu profondes est à évaluer en fonction de la profondeur moyenne, fonction de la taille du cours deau.
Des informations complémentaires sur la caractérisation des faciès pourront être trouvées dans le document « Typologie des faciès découlement » (iii).
Documents de référence
(i) Wasson, J.G., Malavoi, J.R., Maridet, L., Souchon, Y., & Paulin, L. (1998). Impacts écologiques de la chenalisation des rivières. Cemagref éditions, coll. Etudes, série Gestion des Milieux Aquatiques no 14, 158 p. Document téléchargeable sur le site :
http ://www.lyon.cemagref.fr/bea/lhq/dossiers_pdf/chenalisation.PDF.
(ii) Malavoi J.R. & Souchon Y., 2002. Description standardisée des principaux faciès découlement observables en rivière : clé de détermination qualitative et mesures physiques. Bull. Fr. Pêche Piscic., 365/366 : 357-372. Document téléchargeable sur le site :
http ://www.lyon.cemagref.fr/bea/lhq/dossiers_pdf/facies2002.pdf.
(iii) Malavoi, J.R. (1989). Typologie des faciès découlement ou unités morphodynamiques des cours deau à haute énergie. Bull. Fr. Pêche Piscic., 315 : 189-210. Document téléchargeable sur le site :
http ://www.lyon.cemagref.fr/bea/lhq/dossiers_pdf/typo_facies.pdf.
Annexe II
Constituée par le fichier Excel « Protocole Invert RCS final_annexe2.xls » comprenant deux fiches :
fiche terrain à imprimer (aide au recueil dinformation sur le terrain) ;
fiche envoi CEMAGREF (utilisation obligatoire pour la transmission des données).
Annexe III : Liste finie des taxons
Annexe IV : Quantification et identification