(JO n° 109 du 10 mai 2012)
NOR : AGRG1201293D
Publics concernés : détenteurs et demandeurs d’autorisations de mise sur le marché ou de permis pour des produits phytopharmaceutiques et leurs adjuvants, demandeurs d’approbation de substances actives phytopharmaceutiques, de phytoprotecteurs et de synergistes.
Objet : modifications des dispositions relatives aux procédures de mise sur le marché des produits phytopharmaceutiques et de leurs adjuvants et aux procédures d’approbation des substances actives phytopharmaceutiques, des phytoprotecteurs et des synergistes.
Entrée en vigueur : le texte entre en vigueur le 1er juillet 2012.
Notice : ce décret détermine de nouvelles procédures d’autorisation de mise sur le marché pour les produits phytopharmaceutiques et leurs adjuvants ainsi que de nouvelles procédures d’approbation pour les substances actives.
Il prévoit une simplification des démarches administratives d’autorisation de mise sur le marché grâce à une harmonisation accrue des procédures entre les Etats membres de l’Union européenne. Une différenciation des substances actives phytopharmaceutiques est également opérée.
Références : le présent décret est pris pour l’application du règlement (CE) n° 1107/2009 du Parlement européen et du Conseil du 21 octobre 2009 concernant la mise sur le marché des produits phytopharmaceutiques. Il est consultable sur le site Légifrance (http://www.legifrance.gouv.fr).
Vus
Le Premier ministre,
Sur le rapport du ministre de l’agriculture, de l’alimentation, de la pêche, de la ruralité et de l’aménagement du territoire,
Vu le règlement (CE) n° 1272/2008 du Parlement européen et du Conseil du 16 décembre 2008 relatif à la classification, à l’étiquetage et à l’emballage des substances et des mélanges, modifiant et abrogeant les directives 67/548/CEE et 1999/45/CE et modifiant le règlement (CE) n° 1907/2006 ;
Vu le règlement (CE) n° 1107/2009 du Parlement européen et du Conseil du 21 octobre 2009 concernant la mise sur le marché des produits phytopharmaceutiques et abrogeant les directives 79/117/CEE et 91/414/CEE du Conseil ;
Vu le règlement (UE) n° 547/2011 de la Commission du 8 juin 2011 de la Commission du 8 juin 2011 portant application du règlement (CE) n° 1107/2009 du Parlement européen et du Conseil concernant les exigences en matière d’étiquetage des produits phytopharmaceutiques ;
Vu le règlement (UE) n° 545/2011 de la Commission du 10 juin 2011 portant application du règlement (CE) n° 1107/2009 du Parlement européen et du Conseil en ce qui concerne les exigences en matière de données applicables aux produits phytopharmaceutiques ;
Vu le règlement (UE) n° 546/2011 de la Commission du 10 juin 2011 portant application du règlement (CE) n° 1107/2009 du Parlement européen et du Conseil en ce qui concerne les principes uniformes d’évaluation et d’autorisation des produits phytopharmaceutiques ;
Vu la directive 2009/128/CE du Parlement et du Conseil du 21 octobre 2009 instaurant un cadre d’action communautaire pour parvenir à une utilisation des pesticides compatible avec le développement durable ;
Vu le code de la consommation, notamment son article L. 214-1 ;
Vu le code de l’environnement ;
Vu le code rural et de la pêche maritime, notamment le chapitre III du titre V du livre II ;
Vu le code de la santé publique, notamment ses articles L. 1313-1, L. 1341-1, L. 1341-2, R. 1341-10 et R. 1342-20 ;
Vu le code du travail, notamment ses articles R. 4441-44 et R. 4411-74 ;
Vu la loi n° 2000-321 du 12 avril 2000 modifiée relative aux droits des citoyens dans leurs relations avec les administrations, notamment ses articles 21 et 22 ;
Vu l’ordonnance n° 2011-840 du 15 juillet 2011 relative à la mise en conformité des dispositions nationales avec le droit de l’Union européenne sur la mise sur le marché et l’utilisation des produits phytopharmaceutiques, notamment son article 6 ;
Vu le décret n° 97-34 du 15 janvier 1997 modifié relatif à la déconcentration des décisions administratives individuelles ;
Vu le décret n° 97-1202 du 19 décembre 1997 modifié pris pour l’application au ministre chargé de l’agriculture et de la pêche du 1° de l’article 2 du décret n° 97-34 du 15 janvier 1997 relatif à la déconcentration des décisions administratives individuelles ;
Vu le décret n° 97-1203 du 24 décembre 1997 modifié pris pour l’application au ministre de l’agriculture et de la pêche de l’article 2 (2°) du décret n° 97-34 du 15 janvier 1997 relatif à la déconcentration des décisions administratives individuelles ;
Vu le décret n° 2009-626 du 6 juin 2009 relatif à certaines commissions administratives à caractère consultatif relevant du ministère de l’agriculture et de la pêche ;
Vu le décret n° 2011-1325 du 18 octobre 2011 fixant les conditions de délivrance, de renouvellement, de suspension et de retrait des agréments des entreprises et des certificats individuels pour la mise en vente, la distribution à titre gratuit, l’application et le conseil à l’utilisation des produits phytopharmaceutiques ;
Le Conseil d’Etat (section des travaux publics) entendu,
Décrète :
Article 1er du décret du 9 mai 2012
Le chapitre III du titre V du livre II du code rural et de la pêche maritime est remplacé par les dispositions suivantes :
« Chapitre III : Mise sur le marché et utilisation des produits phytopharmaceutiques
« Art. R. 253-1. − Le ministre chargé de l’agriculture est, sauf disposition contraire, l’autorité compétente mentionnée au 1 de l’article 75 du règlement (CE) n° 1107/2009 du Parlement européen et du Conseil du 21 octobre 2009 concernant la mise sur le marché des produits phytopharmaceutiques et abrogeant les directives 79/117/CEE et 91/414/CEE du Conseil, ainsi que l’autorité administrative mentionnée au chapitre III du titre V du livre II du présent code (partie législative).
« Section 1 : Conditions d’autorisation
« Sous-section 1 : Approbation des substances actives, phytoprotecteurs et synergistes
« Art. D. 253-2. − Lorsque la France est désignée comme Etat membre rapporteur ou corapporteur en application de l’article 7 du règlement (CE) no 1107/2009, les dossiers de demande d’approbation, de modification des conditions d’approbation ou de renouvellement de l’approbation, y compris d’une substance à faible risque, d’un phytoprotecteur ou d’un synergiste, sont transmis par le producteur ou une association de producteurs à l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail, ci-après dénommée “l’Agence”, qui en informe sans délai le ministre chargé de l’agriculture.
« L’Agence examine la recevabilité de la demande dans les conditions prévues à l’article 9 du règlement (CE) n° 1107/2009. Elle sollicite du demandeur les éléments manquants et transmet au ministre chargé de l’agriculture, le cas échéant, les demandes de confidentialité. Elle transmet un projet de rapport d’évaluation et, le cas échéant, les éléments complémentaires dont elle dispose au ministre chargé de l’agriculture. Ce dernier détermine les informations devant rester confidentielles et adresse le rapport d’évaluation à la Commission et à l’Autorité européenne de sécurité des aliments, ci-après dénommée “l’Autorité”, dans les conditions prévues à l’article 11 du règlement.
« L’Agence est destinataire des informations complémentaires demandées par l’Autorité au demandeur, dans les conditions prévues à l’article 12 du règlement, et des informations confirmatives supplémentaires mentionnées au f de l’article 6 du règlement. Elle procède à leur évaluation et transmet les résultats de cette évaluation aux autres Etats membres, à la Commission européenne et à l’Autorité, dans les conditions prévues par le règlement, après en avoir informé le ministre chargé de l’agriculture et en l’absence d’objection formelle de celui-ci. L’Agence évalue, le cas échéant, l’équivalence mentionnée à l’article 38 du règlement (CE) n° 1107/2009.
« Art. D. 253-3. − Lorsque la France n’est pas désignée comme Etat membre rapporteur, l’Agence émet, dans les conditions prévues au 1 de l’article 12 du règlement (CE) n° 1107/2009, des observations écrites, qu’elle transmet à l’Autorité après en avoir informé au moins dix jours auparavant le ministre chargé de l’agriculture et en l’absence d’objection formelle de celui-ci.
« Art. D. 253-4. − Le ministre chargé de l’agriculture, le cas échéant sur proposition de l’Agence, peut demander le réexamen d’une substance active, d’un phytoprotecteur ou d’un synergiste, conformément aux dispositions de l’article 21 du règlement (CE) n° 1107/2009. La Commission peut solliciter l’appui scientifique et technique de l’Agence sur ce réexamen, dans les conditions prévues au 2 de cet article.
« Sous-section 2 : Dispositions générales applicables aux autorisations de mise sur le marché et d’utilisation des produits phytopharmaceutiques
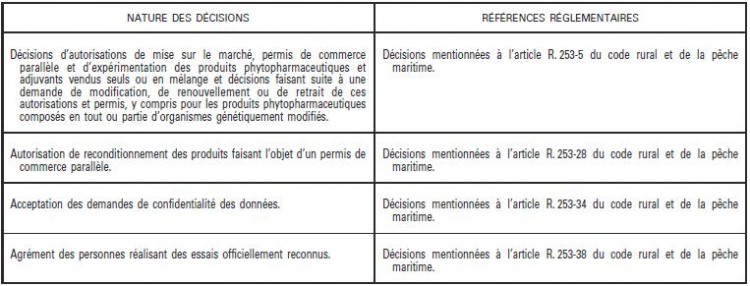
« Art. R. 253-5. − Les autorisations de mise sur le marché des produits phytopharmaceutiques et des adjuvants vendus seuls ou en mélange ainsi que les décisions faisant suite à une demande de modification, de renouvellement ou de retrait de ces autorisations sont délivrées par le ministre chargé de l’agriculture. Sauf dispositions spécifiques prévues au présent chapitre, ces décisions sont délivrées après avis de l’Agence et, pour les demandes relatives aux produits phytopharmaceutiques composés en tout ou partie d’organismes génétiquement modifiés, après avis également du Haut Conseil des biotechnologies.
« Ces décisions peuvent être retirées ou modifiées dans les conditions prévues aux articles 44 à 46 et 51 du règlement (CE) n° 1107/2009, le cas échéant après avis de l’Agence sur les risques et les bénéfices pour la santé publique et l’environnement que présente le produit, notamment en cas de constatations de non-conformité, laissant supposer que tout ou partie des produits phytopharmaceutiques mis sur le marché ne remplissent pas les conditions fixées dans l’autorisation de mise sur le marché ou sont susceptibles de présenter un risque pour la santé publique ou l’environnement.
« Art. R. 253-6. − L’avis de l’Agence n’est pas requis pour les demandes suivantes :
« 1° Pour les demandes d’autorisation de mise sur le marché mentionnées à l’article 53 du règlement (CE) N° 1107/2009 du 21 octobre 2009 ;
« 2° Pour les demandes d’autorisation d’une préparation naturelle peu préoccupante pour laquelle une autorisation a déjà été accordée dans un Etat membre de l’Union européenne selon les principes uniformes visés à l’article 29 du règlement (CE) no 1107/2009 ou pour laquelle un produit phytopharmaceutique de composition équivalente a été autorisé en France depuis plus de dix ans.
« Art. R. 253-7. − Les demandes de modification de nature administrative, ne nécessitant pas qu’une évaluation soit réalisée dans les conditions mentionnées à l’article D. 253-13, notamment les demandes de transfert d’une autorisation ou d’un permis à un autre titulaire, de prise en compte du changement de dénomination sociale du détenteur d’un produit, de changement de dénomination commerciale d’un produit, de changement d’adresse d’une société, de modification d’une autorisation visant à ajouter une nouvelle dénomination commerciale à un produit déjà autorisé, de retrait d’autorisation ou de permis à l’initiative des détenteurs, sont adressées à l’Agence, qui procède aux vérifications du dossier de demande et aux enregistrements rendus nécessaires par la modification en cause dans un délai d’un mois à compter de la date de réception de la demande. Ces demandes de modification ne font pas l’objet d’un avis ou d’une recommandation de l’Agence au sens de l’article L. 1313-1 du code de la santé publique, mais d’une information du ministre chargé de l’agriculture. L’Agence informe le demandeur de cette transmission.
« Le ministre chargé de l’agriculture notifie sa décision au demandeur dans un délai d’un mois à compter de la réception de l’information prévue au premier alinéa.
« A défaut de réponse dans un délai de deux mois après la réception de la demande, celle-ci est considérée comme tacitement acceptée.
« Art. D. 253-8. − I. – Selon les catégories d’utilisateurs, les autorisations de mise sur le marché, les permis de commerce parallèle ou d’expérimentation des produits phytopharmaceutiques sont délivrés pour l’une des gammes d’usages suivantes :
« 1° La gamme d’usages “professionnel”, correspondant à l’ensemble des usages réservés aux utilisateurs professionnels au sens de l’article R. 254-1 ;
« 2° La gamme d’usages “amateur”, correspondant à l’ensemble des usages également à disposition des utilisateurs non professionnels. Seuls peuvent être autorisés pour la gamme d’usages “amateur” les produits :
« – dont la formulation et le mode d’application sont de nature à garantir un risque d’exposition limité pour l’utilisateur. Un arrêté du ministre chargé de l’agriculture précise les catégories de produits ne répondant pas à ce critère ; et
« – dont l’emballage et l’étiquette proposés, outre qu’ils sont conformes aux exigences réglementaires relatives aux conditions d’étiquetage en vigueur, répondent aux conditions fixées par arrêté du ministre chargé de l’agriculture.
« La décision d’autorisation de mise sur le marché des produits relative à la gamme d’usages “amateur” comporte la mention “emploi autorisé dans les jardins”. Sans préjudice des dispositions des articles 40 et 52 du règlement (CE) n° 1107/2009, sont autorisés pour la gamme d’usages “amateur” les produits phytopharmaceutiques bénéficiant d’une autorisation de mise sur le marché dans un autre Etat membre comportant une mention reconnue équivalente.
« Un arrêté du ministre chargé de l’agriculture établit les modalités de mise en conformité des autorisations existantes au regard des deux gammes de produits susvisées.
« II. – Pour l’application du 1 de l’article 31 du règlement (CE) n° 1107/2009, un catalogue national des usages phytopharmaceutiques, rendu public par le ministre chargé de l’agriculture, répertorie les usages autorisés des produits phytopharmaceutiques, qui correspondent notamment à l’association d’un végétal, produit végétal ou famille de végétaux avec un ravageur, groupe de ravageurs, maladie ou groupe de maladies contre lequel le produit est dirigé ou avec une fonction ou un mode d’application de ces produits.
« Art. D. 253-9. − I. – Un produit de composition strictement identique à un autre produit déjà autorisé sur le territoire national, dit “produit de référence”, est dénommé :
« – “produit de seconde gamme” lorsque la demande le concernant est présentée par le titulaire de l’autorisation de mise sur le marché du produit de référence et vise une gamme d’usages différente de celle du produit de référence ;
« – “produit de revente” lorsque la demande le concernant est présentée par un demandeur distinct du titulaire de l’autorisation de mise sur le marché du produit de référence après accord de ce dernier et vise une gamme d’usages identique ou différente de celle du produit de référence.
« II. – Un produit est dénommé “second nom commercial” lorsque la demande le concernant est présentée par le titulaire de l’autorisation de mise sur le marché du produit de référence en vue de modifier l’autorisation de mise sur le marché de ce produit pour lui attribuer une nouvelle dénomination commerciale. La nouvelle dénomination commerciale porte sur une même gamme d’usages et des usages identiques à ceux pour lesquels ce produit a été autorisé, et dans des conditions d’utilisation strictement identiques à celles du produit de référence.
« III. – Les modifications intervenues sur les décisions d’autorisation de mise sur le marché concernant les produits de référence visés au I liées à des mesures de gestion des risques en vue de les atténuer ou lorsqu’elles sont prises pour des motifs de santé publique ou de protection de l’environnement s’appliquent aux seconds noms commerciaux, aux produits de seconde gamme, aux produits de revente et aux produits bénéficiant d’un permis de commerce parallèle autorisés pour les mêmes usages.
« Ces modifications sont publiées par voie électronique.
« IV. – Les modifications intervenues sur les décisions d’autorisation de mise sur le marché concernant les produits de référence visés au I à la demande du titulaire de l’autorisation de ces produits peuvent s’appliquer sur demande de leur titulaire à des autorisations de produits de seconde gamme, de produits de revente ou de permis de commerce parallèle, sous réserve du respect de la réglementation relative à la protection des données.
« V. – Pour l’application de l’article 34 du règlement (CE) n° 1107/2009, on entend par produit phytopharmaceutique générique tout produit phytopharmaceutique qui a la même composition qualitative et quantitative en substances actives et le même type de formulation qu’un produit phytopharmaceutique de rattachement et dont les effets sont comparables à ceux de ce produit de rattachement. Les types de formulations sont définis par des normes internationales élaborées à l’initiative des professionnels sous l’égide de l’Organisation de coopération et de développement économique.
« Art. D. 253-10. − I. – Les demandes sont adressées à l’Agence, à l’exception de celles mentionnées à l’article R. 253-6 qui sont adressées au ministre chargé de l’agriculture.
« Une copie des demandes d’extension des autorisations pour des usages mineurs mentionnées à l’article 51 du règlement (CE) n° 1107/2009 est adressée par le demandeur au ministre chargé de l’agriculture.
« II. – Dès réception du dossier de demande, l’Agence s’assure de sa recevabilité et sollicite du demandeur qu’il le complète, si nécessaire. A réception des éléments complémentaires, si ceux-ci sont transmis par le demandeur dans les délais qui lui ont été impartis et sont conformes à la demande, l’Agence accuse réception du dossier complet et en informe le ministre chargé de l’agriculture. Au cours de l’évaluation du produit, l’Agence peut, en outre, exiger du demandeur qu’il lui fournisse des éléments complémentaires dans les conditions prévues aux articles 33, 52 et 65 du règlement (CE) n° 1107/2009.
« L’Agence prépare, pour chaque demande, un dossier conforme aux dispositions de l’article 39 du règlement (CE) n° 1107/2009. L’Agence transmet au ministre chargé de l’agriculture, le cas échéant, les demandes de confidentialité en application de l’article 63 du même règlement.
« Un arrêté des ministres chargés de l’agriculture, de l’environnement, de la santé, de la consommation et de l’industrie peut préciser la composition et les modalités de présentation des dossiers de demandes.
« Art. D. 253-11. − Sans préjudice des dispositions de l’article D. 253-10, lorsque la France est l’Etat membre rapporteur zonal, l’Agence examine la recevabilité de la demande. Dans les conditions prévues par les articles 35 et 36 du règlement (CE) n° 1107/2009, l’Agence procède à l’évaluation de la demande et sollicite, en tant que de besoin, la coopération des autres Etats membres de la même zone afin de recueillir leurs observations, qui seront examinées lors de l’évaluation.
« Elle réalise, le cas échéant, l’évaluation de l’équivalence dans les conditions prévues à l’article 38 du règlement.
« Elle recueille les observations des autres Etats membres dans les conditions prévues par les dispositions des articles 35 et 38 du règlement, puis transmet son avis au ministre chargé de l’agriculture.
« Art. D. 253-12. − Lorsque la France n’est pas désignée comme Etat membre rapporteur zonal, l’Agence transmet ses observations au ministre chargé de l’agriculture ainsi qu’à l’Etat membre rapporteur, afin que celui-ci en dispose pour conduire son évaluation.
« L’Agence transmet ses observations sur le rapport d’évaluation au ministre chargé de l’agriculture, en mentionnant, le cas échéant, celles de ses observations qui n’auraient pas été prises en compte par l’Etat membre rapporteur.
« Art. D. 253-13. − Les avis sont formulés par l’Agence à l’issue des évaluations conduites en application des dispositions de la présente sous-section, et conformément aux principes uniformes d’évaluation mentionnés au 6 de l’article 29 du règlement (CE) n° 1107/2009. Les avis comportent une synthèse de chaque point d’évaluation mentionné à l’annexe du règlement (UE) no 546/2011 de la Commission du 10 juin 2011, assortie de recommandations portant notamment sur les conditions d’emploi des produits.
« Art. D. 253-14. − I. – L’Agence dispose d’un délai de dix mois, à compter de la date de réception de la demande ou de l’approbation de la substance active, pour transmettre au ministre chargé de l’agriculture son avis sur :
« – les demandes d’autorisation de mise sur le marché d’un produit phytopharmaceutique contenant une substance active non encore approuvée, conformément à l’article 30 du règlement (CE) n° 1107/2009 ;
« – les demandes d’autorisation d’un nouveau produit ;
« – les demandes d’extension d’usages autres que mineurs d’une autorisation de mise sur le marché ;
« – les demandes d’autorisation d’un produit de seconde gamme ou d’un produit de revente lorsque la demande porte sur un produit destiné à une autre gamme d’usages que le produit de référence.
« II. – L’Agence dispose d’un délai de quatre-vingt-dix jours, à compter de la date de réception de la demande, pour transmettre au ministre chargé de l’agriculture son avis sur les demandes d’autorisation de mise sur le marché d’une préparation contenant exclusivement une ou plusieurs substances à faible risque, au sens de l’article 22 du règlement (CE) n° 1107/2009 ou contenant exclusivement une ou plusieurs substances de base au sens de l’article 23 du règlement (CE) n° 1107/2009.
« III. – L’Agence dispose d’un délai de huit mois, à compter de la date de réception de la demande pour transmettre au ministre chargé de l’agriculture son avis sur les demandes de renouvellement d’une autorisation de mise sur le marché d’un produit phytopharmaceutique mentionnées à l’article 43 du règlement (CE) n° 1107/2009.
« IV. – L’Agence dispose d’un délai de cinq mois, à compter de la date de réception de la demande, pour transmettre au ministre chargé de l’agriculture son avis sur :
« – les demandes de changement d’emballage, d’étiquetage et les demandes de changement de classement reposant sur de nouvelles études d’un produit déjà autorisé ;
« – les demandes d’extension des autorisations pour des usages mineurs mentionnées à l’article 51 du règlement (CE) n° 1107/2009 ;
« – les demandes de changement mineur de la composition d’un produit déjà autorisé ;
« – les demandes relatives aux produits génériques mentionnés à l’article 34 du règlement (CE)
N° 1107/2009 ;
« – les demandes d’autorisation d’un produit de seconde gamme ou d’un produit de revente lorsque la demande porte sur un produit destiné à une même gamme d’usages que le produit de référence ;
« – les demandes portant sur des modifications des conditions d’emploi prévues par l’autorisation de mise sur le marché d’un produit déjà autorisé, ou des mentions qui s’y rapportent.
« V. – L’Agence dispose d’un délai de cinq mois, à compter de l’approbation de la substance active, pour transmettre au ministre chargé de l’agriculture son avis sur les demandes portant sur les produits représentatifs mentionnées au 3 de l’article 37 du règlement (CE) n° 1107/2009.
« VI. – L’Agence dispose d’un délai de quatre-vingt-dix jours, à compter de la date de réception de la demande, pour transmettre au ministre chargé de l’agriculture son avis sur les demandes d’autorisation de mise sur le marché au titre de la reconnaissance mutuelle mentionnées à l’article 40 du règlement (CE) n° 1107/2009.
« VII. – L’Agence dispose d’un délai de quatre-vingt-dix jours, à compter de la réception de la copie de l’autorisation de mise sur le marché et du rapport d’évaluation transmis par l’Etat membre rapporteur visés au 4 de l’article 37 du règlement (CE) n° 1107/2009, pour transmettre au ministre chargé de l’agriculture l’avis mentionné à l’article D. 253-13.
« VIII. – L’Agence dispose d’un délai de cinquante-cinq jours à compter de la réception d’un dossier pour transmettre au ministre chargé de l’agriculture son avis sur les demandes d’équivalence déposées en application de l’article 38 du règlement (CE) n° 1107/2009 lorsque ces demandes sont effectuées indépendamment de toute demande d’autorisation d’un produit.
« IX. – L’Agence joint aux avis mentionnés aux I à VIII du présent article la copie du rapport d’évaluation du produit concerné par la demande ou des préparations représentatives d’une substance active approuvée. Elle précise si les rapports d’essais et d’études répondent aux conditions des a et b du 1 de l’article 59 du règlement (CE) n° 1107/2009. Elle informe le demandeur de cette transmission.
« X. – L’Agence transmet également les avis concernant les demandes mentionnées aux I et III, au dernier alinéa du IV et aux VI et VII aux ministres chargés de la santé, du travail, de la consommation et de l’environnement, qui peuvent formuler des observations ou demander à être consultés par le ministre chargé de l’agriculture sur son projet de décision, dans les conditions précisées par un arrêté interministériel.
« XI. – Les avis de l’Agence sont rendus publics, après l’intervention de la décision du ministre de l’agriculture sur les demandes mentionnées au présent article.
« XII. – Les délais prévus aux paragraphes I à V et au paragraphe VIII du présent article sont fixés sans préjudice des éventuels délais supplémentaires impartis par l’Agence au demandeur pour lui fournir les informations complémentaires requises.
« Art. D. 253-15. − I. – Le ministre chargé de l’agriculture prend sa décision dans des délais qui courent à compter de la date à laquelle l’Agence informe les demandeurs, conformément au IX de l’article D. 253-14, de la transmission de son avis.
« Ce délai est de :
« – deux mois pour les demandes mentionnées au I de l’article D. 253-14 ;
« – un mois pour les demandes mentionnées aux II à VII de l’article D. 253-14 ;
« – cinq jours pour les demandes mentionnées au VIII de l’article D. 253-14.
« II. – Si l’Agence n’a pas émis l’avis prévu à l’article D. 253-13 ou un avis spécifique faisant état d’un risque avéré à l’issue des délais qui lui sont impartis, le ministre chargé de l’agriculture peut autoriser :
« 1° Un produit ou un usage au titre de la reconnaissance mutuelle mentionnée à l’article 40 du règlement (CE) n° 1107/2009 et au VI de l’article D. 253-14, en se fondant sur l’évaluation conduite par un autre Etat membre dans les conditions prévues au 1 de l’article 36 du règlement (CE) n° 1107/2009 ;
« 2° Une extension d’autorisation pour des usages mineurs mentionnée à l’article 51 du règlement (CE) N° 1107/2009.
« III. – L’absence de décision à l’issue des délais prévus au I vaut décision de rejet, sauf s’agissant des décisions d’autorisation de mise sur le marché se rapportant à une demande formée au titre du 1 de l’article 41 du règlement (CE) n° 1107/2009 du 21 octobre 2009, qui sont des décisions tacites d’acceptation.
« IV. – Le ministre chargé de l’agriculture transmet les décisions relatives aux autorisations de mise sur le marché mentionnées à l’article 53 du règlement (CE) n° 1107/2009 aux ministres chargés de la santé, du travail, de la consommation et de l’environnement.
« V. – Les autorisations de mise sur le marché faisant l’objet d’une demande de renouvellement en application de l’article 43 du règlement (CE) n° 1107/2009 sont prolongées pendant la durée nécessaire au renouvellement de l’autorisation du produit consécutive au renouvellement de l’approbation de la substance active qu’il contient.
« Art. D. 253-16. − Le ministre chargé de l’agriculture notifie sa décision au demandeur et en adresse copie à l’Agence.
« Lorsque la France a été désignée comme Etat membre rapporteur zonal, une copie de la décision et du rapport d’évaluation est transmise aux autres Etats membres par le ministre chargé de l’agriculture.
« Lorsque la France n’a pas été désignée comme Etat membre rapporteur, le ministre chargé de l’agriculture est destinataire des décisions et rapports d’évaluation établis par les autres Etats membres, qu’il communique à l’Agence.
« Art. D. 253-17. − Les décisions relatives à la mise sur le marché des produits visés à l’article L. 253-1 sont rendues publiques par voie électronique par l’Agence, dans les conditions prévues à l’article 57 du règlement (CE) n° 1107/2009.
« Sous-section 3 : Mise sur le marché des produits phytopharmaceutiques composés en tout ou partie d’organismes génétiquement modifiés
« Art. D. 253-18. − Outre les éléments exigés par l’article R. 533-26 du code de l’environnement, les demandes relatives à la mise sur le marché des produits phytopharmaceutiques composés en tout ou partie d’organismes génétiquement modifiés mentionnées à l’article 48 du règlement (CE) n° 1107/2009 du 21 octobre 2009 comportent :
« 1° Un dossier, pour chaque substance active contenue dans le produit, lorsqu’elle est différente de l’organisme génétiquement modifié, satisfaisant aux exigences relatives à l’inscription de la substance active sur la liste communautaire prévue par la réglementation de l’Union européenne ;
« 2° Un dossier relatif au produit phytopharmaceutique comprenant les études et comptes rendus d’essais tels que définis au 3 de l’article 29 du règlement (CE) n° 1107/2009 et démontrant que le produit satisfait, pour les conditions d’emploi demandées, aux exigences de sélectivité, d’efficacité et d’innocuité prévues par la réglementation de l’Union européenne ;
« 3° Le versement de la taxe mentionnée à l’article L. 535-4 du code de l’environnement.
« La composition et les modalités de présentation des dossiers mentionnés au 1° et au 2° sont définies par arrêté des ministres chargés de l’agriculture, de l’environnement, de la santé, de la consommation et de l’industrie.
« Art. D. 253-19. − Dès réception de la demande, l’Agence transmet au ministre chargé de l’agriculture la synthèse du dossier pour transmission à la Commission européenne et, le cas échéant, la demande de reconnaissance du caractère confidentiel de certaines informations figurant dans la demande d’autorisation.
« Lorsque le dossier est complet, elle transmet la demande au Haut Conseil des biotechnologies et au ministre chargé de l’agriculture, qui les transmet à la Commission européenne.
« L’Agence procède à l’instruction de la demande parallèlement au Haut Conseil des biotechnologies.
« Au vu des avis de l’Agence et du Haut Conseil des biotechnologies, le ministre chargé de l’agriculture établit le rapport d’évaluation mentionné à l’article R. 533-30 du code de l’environnement.
« Art. D. 253-20. − L’autorisation délivrée dans les conditions prévues à l’article R. 253-5 vaut autorisation de mise sur le marché au sens des dispositions du présent chapitre et de l’article L. 533-5 du code de l’environnement.
« Art. D. 253-21. − Lorsque la substance active mentionnée au 2 de l’article 2 du règlement (CE) N° 1107/2009 est composée en tout ou partie d’organismes génétiquement modifiés et que la France est désignée comme Etat membre rapporteur, le rapport d’évaluation est établi par l’Agence, qui intègre l’avis du Haut Conseil des biotechnologies.
« Sous-section 4 : Dispositions applicables aux préparations naturelles peu préoccupantes à usage phytopharmaceutique
« Art. D. 253-22. − I. – On entend par “préparation naturelle peu préoccupante à usage phytopharmaceutique”, au sens du deuxième alinéa de l’article L. 253-1, tout produit qui est composé exclusivement d’une ou plusieurs substances de base, au sens de l’article 23 du règlement (CE) n° 1107/2009 ou d’une ou plusieurs substances actives à faible risque au sens de l’article 22 du même texte et satisfaisant aux conditions fixées à l’article 47 de ce texte ainsi qu’à celles énoncées aux II et III du présent article.
« II. – Une préparation naturelle peu préoccupante à usage phytopharmaceutique composée exclusivement d’une ou plusieurs substances de base doit :
« 1° Pouvoir être obtenue par un procédé accessible à tout utilisateur final ;
« 2° Etre composée d’une ou plusieurs substances non traitées, ou traitées uniquement par des moyens manuels, mécaniques ou gravitationnels, par dissolution dans l’eau, par flottation, par extraction par l’eau, par distillation à la vapeur ou par chauffage uniquement pour éliminer l’eau.
« III. – On entend par “procédé accessible à tout utilisateur final”, au sens du 2o du I du présent article, tout procédé pour lequel l’utilisateur final est capable de réaliser toutes les étapes de la préparation. Néanmoins, la matière première peut avoir été acquise auprès d’entreprises extérieures lorsque celles-ci sont seules capables de la fournir et si ces dernières ne réalisent pas elles-mêmes la préparation.
« Sous-section 5 : Permis de commerce parallèle
« Art. R. 253-23. − Les permis de commerce parallèle ainsi que les décisions faisant suite à une demande de modification, de renouvellement ou de retrait de ces permis sont pris par le ministre chargé de l’agriculture. L’avis de l’Agence sur les demandes de permis de commerce parallèle et de renouvellement de ces permis comporte un examen d’identité réalisé conformément au 3 de l’article 52 du règlement (CE) n° 1107/2009. Pour l’établir, l’Agence peut utiliser les informations contenues dans le dossier du produit de référence ou celles mises à sa disposition par l’Etat membre d’origine.
« A la demande du détenteur, le permis de commerce parallèle peut être renouvelé si les conditions requises pour son obtention sont toujours remplies.
« Le permis est prolongé pendant la période nécessaire à la vérification du respect de ces conditions.
« Art. D. 253-24. − I. – L’Agence dispose d’un délai de quarante-cinq jours, à compter de la réception d’un dossier complet, pour donner un avis au ministre chargé de l’agriculture sur les demandes de permis de commerce parallèle mentionnées à l’article 52 du règlement (CE) n° 1107/2009 et les demandes de renouvellement de ces permis.
« Elle dispose du même délai pour les demandes de modification d’un permis, visant à permettre l’introduction d’un autre produit du même Etat membre d’origine ou d’un autre Etat membre d’origine que celui pour lequel le permis a été délivré.
« II. – L’Agence dispose d’un délai de trente-cinq jours, à compter de la réception d’un dossier complet, pour donner un avis au ministre chargé de l’agriculture sur les demandes de permis de commerce parallèle pour un produit dont l’introduction est permise sur le territoire national depuis moins d’un an, lorsque la demande porte sur un produit provenant du même Etat membre que le produit introduit grâce au permis déjà accordé.
« III. – Lorsque l’Agence sollicite des informations auprès de l’Etat membre d’origine, les délais prévus au présent article sont suspendus dans les conditions prévues au 2 de l’article 52 du règlement (CE) n° 1107/2009.
« IV. – Les avis de l’Agence sont rendus publics dans les conditions prévues au XI de l’article D. 253-14.
« Art. D. 253-25. − Le ministre chargé de l’agriculture notifie sa décision au demandeur dans un délai de quinze jours à compter de la réception de l’avis de l’Agence, à qui il adresse copie de la décision.
« Si l’Agence n’a pas émis son avis dans les délais qui lui sont impartis, le ministre chargé de l’agriculture peut prendre sa décision, après avoir procédé à un examen d’identité du produit. L’absence de décision à l’issue des délais fixés par le présent article vaut décision de rejet.
« Art. R. 253-26. − Le ministre chargé de l’agriculture met à la disposition du public par voie électronique une liste régulièrement actualisée des produits dont l’introduction est permise sur le territoire national suite à la délivrance d’un permis de commerce parallèle, mentionnant l’Etat membre d’origine et le produit de référence ainsi que les mentions d’étiquetage obligatoires en langue française du produit de référence.
« La liste ainsi publiée vaut permis de commerce parallèle pour un usage personnel pour chacun des produits qui y sont listés, pour les personnes mentionnées à l’article R. 253-27.
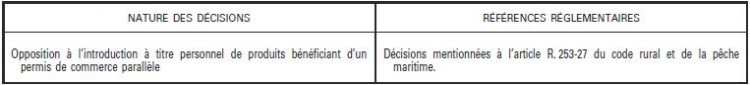
« Art. R. 253-27. − I. – Pour l’application de l’article R. 253-26, constitue une introduction de produits phytopharmaceutiques pour usage personnel le fait, pour les personnes exerçant une activité dans une exploitation agricole au sens de l’article L. 311-1, d’introduire, pour les seuls besoins de cette exploitation, un produit phytopharmaceutique pour lequel un permis de commerce parallèle a déjà été délivré. La personne procédant à l’introduction d’un produit phytopharmaceutique pour usage personnel en fait la déclaration au préfet de la région du lieu de sa résidence administrative, en précisant les quantités nécessaires à l’exploitation et la date d’introduction des produits, dans un délai minimum de vingt jours avant cette date. Le préfet accuse immédiatement réception de cette déclaration d’introduction, à laquelle il peut s’opposer dans un délai de quinze jours.
« II. – Lorsque la personne mentionnée au I emploie des personnes susceptibles d’utiliser les produits introduits, elle affiche dans son local de stockage des produits phytopharmaceutiques les mentions d’étiquetage obligatoires mentionnées à l’article R. 253-26.
« Art. R. 253-28. − Le reconditionnement des produits bénéficiant d’un permis de commerce parallèle est interdit, sauf si le ministre chargé de l’agriculture l’a autorisé, à la demande du demandeur, dans le cadre de la demande de permis de commerce parallèle.
« Le reconditionnement n’est autorisé que sous réserve du respect des conditions suivantes :
« 1° Le reconditionnement est nécessaire pour accéder au marché national, en raison de ses contraintes spécifiques, liées à l’emballage ou au contenant du produit ;
« 2° L’intégrité et la traçabilité du produit introduit sont garanties ;
« 3° Le titulaire de l’autorisation de mise sur le marché du produit introduit a été préalablement informé du reconditionnement envisagé.
« Art. R. 253-29. − Sans préjudice des dispositions du 8 de l’article 52 du règlement (CE) n° 1107/2009, le ministre chargé de l’agriculture peut retirer ou modifier le permis de commerce parallèle dans le respect des exigences fixées à l’article 44 de ce règlement :
« 1° En cas de constatation de non-conformité d’un lot de produits lorsque cette non-conformité consiste à substituer volontairement un autre produit au produit d’origine pour lequel le permis a été délivré ;
« 2° En cas de constatations de non-conformité de lots de produits laissant supposer que tout ou partie des produits mis sur le marché ne remplissent pas les conditions pour lesquelles le permis de commerce parallèle a été délivré et sont susceptibles de présenter un risque pour la santé publique et l’environnement.
« Sous-section 6 : Permis d’expérimentation
« Art. R. 253-30. − I. – Le permis mentionné à l’article 54 du règlement (CE) n° 1107/2009 pour effectuer des essais, expériences ou études de produits phytopharmaceutiques et adjuvants ainsi que les décisions faisant suite à une demande de modification, de renouvellement ou de retrait de ce permis sont délivrés par le ministre chargé de l’agriculture pour une durée qui ne peut excéder trois ans, dans les conditions prévues par cet article et par la section 1 du présent chapitre. Les productions végétales issues des essais, expériences ou études et susceptibles d’être consommées par l’homme ou l’animal sont détruites, sauf si le permis prévoit une dérogation à l’obligation de destruction des récoltes.
« II. – Si les essais, expériences, ou études sont susceptibles de présenter des effets nocifs pour la santé humaine ou animale ou inacceptables pour l’environnement et si aucune mesure de gestion des risques ne permet de les atténuer, le ministre chargé de l’agriculture peut refuser d’accorder le permis et s’opposer à la réalisation des essais officiellement reconnus mentionnés au II de l’article R. 253-38 ou dans les conditions mentionnées au II de l’article R. 253-39.
« III. – Le permis peut être retiré ou modifié par le ministre chargé de l’agriculture s’il apparaît que les conditions exigées pour sa délivrance cessent d’être réunies.
« Art. R. 253-31. − Les demandes mentionnées au 2 de l’article 54 du règlement (CE) n° 1107/2009 sont adressées à l’Agence avant la date prévue pour le début de l’expérimentation, dans des conditions pouvant être précisées par arrêté du ministre chargé de l’agriculture. Les décisions portant sur les demandes déposées au-delà de ce délai seront délivrées pour la campagne de culture suivante.
« A réception d’un dossier complet, l’Agence dispose d’un délai de cinq mois pour donner son avis.
« Le ministre chargé de l’agriculture notifie sa décision au demandeur dans un délai n’excédant pas un mois à compter de la réception de l’avis de l’Agence, à qui il adresse copie de la décision.
« L’absence de décision à l’issue des délais fixés par le présent article vaut décision de rejet.
« Si le titulaire du permis souhaite apporter des modifications aux conditions dans lesquelles il procède à l’expérimentation, il est tenu d’en informer préalablement le ministre chargé de l’agriculture, qui peut s’y opposer dans un délai d’un mois.
« Art. D. 253-32. − I. – Les personnes agréées dans les conditions mentionnées au II de l’article R. 253-38 et les laboratoires reconnus conformes aux bonnes pratiques de laboratoire dans les conditions mentionnées au II de l’article R. 253-39 peuvent réaliser sans permis des essais ou expériences à des fins de recherche ou développement impliquant l’émission dans l’environnement :
« – de quantités et sur des surfaces limitées de prototypes de produit phytopharmaceutique contenant de nouvelles substances actives ou de nouvelles compositions ou de nouveaux types de formulation de produits, dont ils sont propriétaires ou par des personnes placées sous leur contrôle ; ou
« – d’un produit phytopharmaceutique bénéficiant d’une autorisation, nationale ou délivrée par un autre Etat membre de l’Union européenne, pour un autre usage, en application du règlement (CE) n° 1107/2009 ; ou
« – d’un produit légalement mis sur le marché dont la destination principale n’est pas d’être utilisé à des fins phytosanitaires, mais qui est néanmoins utile dans la protection phytosanitaire.
« II. – Un arrêté du ministre chargé de l’agriculture précise les conditions dans lesquelles les essais et
expériences peuvent être effectués, notamment les surfaces d’expérimentation autorisées, et les conditions dans lesquelles les personnes réalisant certains essais ou expériences impliquant l’émission dans l’environnement d’un produit phytopharmaceutique sont tenues d’en faire préalablement la déclaration.
« Art. D. 253-33. − Le permis pour expérimentation délivré pour la dissémination volontaire dans l’environnement de produits phytopharmaceutiques composés en tout ou partie d’organismes génétiquement modifiés en application de l’article 54 du règlement (CE) n° 1107/2009 et de la présente section est l’autorisation mentionnée à l’article L. 533-3 du code de l’environnement.
« Section 2 : Confidentialité, information et protection des données
« Art. R. 253-34. − Le ministre chargé de l’agriculture statue sur toutes les demandes de confidentialité qui lui sont transmises. Il notifie sa décision sur ces demandes au moment de la délivrance de la décision d’autorisation de mise sur le marché.
« Art. D. 253-35. − I. – Le détenteur d’une autorisation de mise sur le marché ou tout bénéficiaire d’une extension d’autorisation pour un usage mineur d’un produit mentionné à l’article 51 du règlement (CE) n° 1107/2009 communique au ministre chargé de l’agriculture et à l’Agence les informations mentionnées à l’article 56 du règlement.
« Si la première autorisation d’un produit au sein de la zone sud a été délivrée sur le territoire national, l’Agence évalue ces informations et transmet le résultat de cette évaluation au ministre chargé de l’agriculture, qui informe la Commission européenne et les autres Etats membres de la zone, dans les conditions prévues par le 3 de l’article 56 du règlement précité.
« II. – Le détenteur d’un permis de commerce parallèle communique au ministre chargé de l’agriculture et à l’Agence les informations mentionnées au 4 de l’article 56 du règlement précité et une copie de l’étiquette du produit mise à jour suite aux modifications intervenues sur le produit de référence, après la délivrance du permis.
« Art. D. 253-36. − La protection du secret de la composition intégrale des produits, lorsque cette formule est communiquée aux organismes chargés de la toxicovigilance conformément aux dispositions des articles L. 1341-1 et L. 1342-1 du code de la santé publique, est assurée dans les conditions prévues à l’article L. 253-2.
« Art. R. 253-37. − Les articles R. 523-12 à R. 523-21 du code de l’environnement s’appliquent aux substances à l’état nanoparticulaire entrant dans la composition des produits mentionnés à l’article L. 253-1.
« Section 3 : Essais, analyses et études
« Art. R. 253-38. − I. – Sont considérés comme essais officiels les essais visés au 2.2 de l’annexe au règlement (UE) n° 545/2011 réalisés par des services et organismes énumérés par arrêté du ministre chargé de l’agriculture.
« II. – Sont considérés comme essais officiellement reconnus les essais visés au 2.2 de l’annexe au règlement (UE) n° 545/2011 qui font l’objet de déclarations auprès du ministre chargé de l’agriculture par le demandeur de l’autorisation de mise sur le marché ou pour le compte de ce dernier et qui sont réalisés par toute personne physique ou morale agréée à cet effet par le ministre chargé de l’agriculture, selon les modalités définies par arrêté, après évaluation de leur conformité aux principes des bonnes pratiques d’expérimentation par le Comité français d’accréditation (COFRAC) ou par un organisme d’accréditation signataire de l’accord multilatéral pris dans le cadre de la coordination européenne des organismes d’accréditation.
« La décision d’agrément est délivrée par le ministre chargé de l’agriculture dans un délai de trois mois à compter de la remise du rapport d’évaluation de leur conformité aux principes des bonnes pratiques d’expérimentation.
« Art. R. 253-39. − I. – Sont aussi considérés comme officiels au sens du 3 de l’article 29 du règlement (CE) n° 1107/2009 les essais et analyses, non visés à l’article R. 253-38, réalisés par des services et organismes définis par arrêté du ministre chargé de l’agriculture, selon les protocoles et lignes directrices mentionnés au 2° du II.
« II. – Sont aussi considérés comme officiellement reconnus au sens du 3 de l’article 29 du règlement (CE) n° 1107/2009 les essais et analyses non visés à l’article R. 253-38 réalisés :
« 1° Par les laboratoires reconnus conformes aux bonnes pratiques de laboratoire dans les conditions prévues par les articles D. 523-8 à D. 523-11 du code de l’environnement, sous réserve de dérogations particulières en application de décisions communautaires ;
« 2° Et selon des protocoles communautaires ou internationaux ou, à défaut, selon des lignes directrices dont la reconnaissance est acceptée par le ministre chargé de l’agriculture après avis de l’Agence et par le Haut Conseil des biotechnologies lorsqu’il s’agit de produits phytopharmaceutiques composés en tout ou partie d’organismes génétiquement modifiés.
« Art. R. 253-40. − L’Agence tient à jour les listes des rapports d’essais et d’études mentionnées à l’article 60 du règlement (CE) n° 1107/2009. Elle met la liste mentionnée au 1 de l’article précité à la disposition des Etats membres et de la Commission. Les demandes mentionnées au 2 du même article sont faites auprès du ministre chargé de l’agriculture, qui y répond dans les conditions prévues à l’article 61 du règlement précité.
« Section 4 : Emballage et étiquetage
« Art. R. 253-41. − Sur les emballages et étiquettes des produits dont la mise sur le marché est autorisée pour la gamme d’usages “amateur”, est apposée visiblement la mention “emploi autorisé dans les jardins”.
« Art. R. 253-42. − I. – Les modifications de classement des produits et de leurs étiquettes visées à l’article L. 253-4 sont notifiées par le titulaire de l’autorisation de mise sur le marché ou du permis de commerce parallèle au ministre chargé de l’agriculture au plus tard deux mois avant la date d’entrée en application d’un règlement pris aux fins d’adaptation au progrès technique et scientifique du règlement (CE) n° 1272/2008.
« Le ministre chargé de l’agriculture publie le nouveau classement du produit par voie électronique dans un délai maximum de deux mois à compter de la date de notification du changement de classement.
« Le titulaire de l’autorisation de mise sur le marché ou du permis de commerce parallèle met sur le marché des produits classés et étiquetés conformément au règlement mentionné au I à la date d’application de ce règlement.
« Les stocks de produits dont la première mise sur le marché français est antérieure à l’entrée en application du règlement mentionné au I peuvent être commercialisés pendant une période de six mois suivant la date d’application de ce règlement.
« Les stocks de produits dont la première mise sur le marché français est antérieure à l’entrée en application du règlement mentionné au I peuvent être utilisés pendant une période de dix-huit mois suivant la date d’application de ce règlement.
« II. – En cas de modification de la décision d’autorisation de mise sur le marché entraînant une modification de l’étiquetage du produit, le titulaire de l’autorisation met sur le marché des produits étiquetés conformément à l’autorisation dans un délai de six mois à compter de la notification de l’autorisation de mise sur le marché de modification et met à jour les étiquettes des produits commercialisés dans ce même délai. Dans les cas où la modification de la décision d’autorisation de mise sur le marché consiste en un élargissement des usages du produit ou en un allégement de ses précautions d’utilisation, ce délai est porté à un an.
« Les stocks de produits dont la première mise sur le marché français est antérieure à la date limite de mise à jour des étiquettes des produits peuvent être utilisés pendant une période de douze mois à compter de cette date limite de mise à jour.
« Ces délais de mise à jour des étiquettes et d’écoulement des stocks ne s’appliquent pas dans les cas où la décision de modification de l’autorisation de mise sur le marché ou un arrêté du ministre chargé de l’agriculture prévoient des délais différents.
« Art. R. 253-43. − I. – Les produits mentionnés à l’article L. 253-1 sont mis sur le marché et conservés dans leur contenant et emballage d’origine jusqu’au moment de leur utilisation.
« Les emballages utilisés pour les besoins des opérations de manutention doivent présenter les mêmes garanties que celles qui étaient assurées par l’emballage d’origine.
« II. – Les conditions d’étiquetage des produits mentionnés à l’article L. 253-1 sont précisées par arrêté des ministres chargés de l’agriculture, de la santé, de l’environnement et de la consommation.
« Section 5 : Plan d’action national pour une utilisation durable des produits phytopharmaceutiques
« Art. D. 253-44. − La “lutte intégrée contre les ennemis des cultures” mentionnée à l’article 55 du
règlement (CE) n° 1107/2009 et à l’article L. 253-6 s’entend comme la prise en considération attentive de toutes les méthodes de protection des plantes disponibles et, par conséquent, l’intégration des mesures appropriées qui découragent le développement des populations d’organismes nuisibles et maintiennent le recours aux produits phytopharmaceutiques et à d’autres types d’interventions à des niveaux justifiés du point de vue économique et environnemental, et réduisent ou limitent au maximum les risques pour la santé humaine et l’environnement. La lutte intégrée contre les ennemis des cultures privilégie la croissance de cultures saines en veillant à perturber le moins possible les agro-écosystèmes et encourage les mécanismes naturels de lutte contre les ennemis des cultures.
« Section 6 : Mesures de précaution
« Art. R. 253-45. − L’autorité administrative mentionnée à l’article L. 253-7 est le ministre chargé de l’agriculture.
« Toutefois, lorsque les mesures visées au premier alinéa de l’article L. 253-7 concernent l’utilisation et la détention de produits visés à l’article L. 253-1, elles sont prises par arrêté conjoint des ministres chargés de l’agriculture, de la santé, de l’environnement et de la consommation.
« Art. R. 253-46. − I. – L’autorité administrative mentionnée à l’article L. 253-8 est le préfet du département dans lequel a lieu la pulvérisation aérienne de produits phytopharmaceutiques. Un arrêté des ministres chargés de l’agriculture, de l’environnement et de la santé détermine les conditions dans lesquelles le préfet peut délivrer des dérogations à l’interdiction de pulvérisation aérienne.
« II. – L’Agence évalue spécifiquement les risques liés à la pulvérisation aérienne. Les produits phytopharmaceutiques utilisés en pulvérisation aérienne sont expressément approuvés à cet effet sur la base de cette évaluation par décision du ministre chargé de l’agriculture.
« Section 7 : Elimination des produits dont l’utilisation n’est pas autorisée
« Art. R. 253-47. − L’autorité administrative mentionnée à l’article L. 253-12 est le préfet de région.
« Art. R. 253-48. − I. – Les délais mentionnés à l’article L. 253-11 pour les opérations conduisant à l’élimination des produits phytopharmaceutiques sont :
« 1° D’un an pour les opérations de collecte de ces produits chez les utilisateurs finaux à compter des dates
mentionnées à l’article L. 253-11 ;
« 2° D’un an pour le traitement final de ces produits à compter de l’expiration du délai d’un an visé au 1°.
« II. – Lorsque l’urgence ou des risques particuliers pour la santé publique ou l’environnement le justifient, le ministre chargé de l’agriculture peut imposer des délais de collecte et de traitement plus courts que ceux mentionnés au I, dans la décision de retrait du produit phytopharmaceutique concerné.
« Section 8 : Inspection et contrôle
« Art. R. 253-49. − I. – Les prélèvements effectués en application de l’article L. 250-6 portent sur trois échantillons :
« – l’un est destiné au laboratoire pour analyse ;
« – les deux autres, utilisés dans le cas où une expertise contradictoire est demandée, sont conservés, d’une part, par le détenteur du produit, produit végétal ou d’origine végétale ayant fait l’objet du prélèvement et, d’autre part, par la direction régionale de l’agriculture et de la forêt ou, pour les départements d’outre-mer, par la direction de l’agriculture et de la forêt dont relève l’agent qui a procédé au prélèvement.
« II. – A chaque échantillon prélevé est attribué un numéro d’identification.
« III. – Si le détenteur du produit, produit végétal ou d’origine végétale refuse de conserver en dépôt l’échantillon qui lui est destiné, il est fait mention de ce refus sur l’étiquette qui accompagne l’échantillon ainsi que dans le procès-verbal prévu à l’article R. 253-50. L’échantillon est, dans ce cas, conservé par l’administration.
« IV. – Tout échantillon identifié est mis sous scellés. Les informations devant être mentionnées sur les scellés sont fixées par arrêté du ministre chargé de l’agriculture.
« Art. R. 253-50. − Les prélèvements d’échantillons font l’objet d’un procès-verbal de prélèvement comportant notamment, outre l’exposé des faits motivant la rédaction de celui-ci, les informations suivantes :
« – date, heure et lieu du prélèvement ;
« – identité du produit ayant fait l’objet du prélèvement ;
« – nature et volume des échantillons prélevés ;
« – numéro d’identification des échantillons ;
« – marques et étiquettes apposées sur le produit ayant fait l’objet du prélèvement ;
« – nom, prénoms et adresse du détenteur de ce produit ;
« – nom, prénoms, qualité et signature de l’agent ayant rédigé le procès-verbal.
« Le détenteur d’un produit ayant fait l’objet d’un prélèvement peut faire insérer toutes les observations qu’il juge utiles dans le procès-verbal, qu’il est invité à signer. S’il est absent ou refuse de signer, mention en est faite dans le procès-verbal.
« Art. R. 253-51. − Des arrêtés du ministre chargé de l’agriculture déterminent en tant que de besoin, pour chacun des produits, produits végétaux ou d’origine végétale susceptibles de faire l’objet d’un prélèvement, la quantité à prélever, les procédés nécessaires à l’obtention d’échantillons homogènes ainsi que les modalités de transport et de conservation des échantillons.
« Art. R. 253-52. − Si les produits, produits végétaux ou d’origine végétale ayant donné lieu à un prélèvement d’échantillons ne font pas l’objet d’une mesure de consignation dans l’attente des résultats d’analyse, les agents mentionnés à l’article L. 250-2 peuvent demander au détenteur de ces produits de leur faire connaître la destination de ceux-ci.
« Art. R. 253-53. − I. – En vue de déterminer les risques résultant de la mise sur le marché des produits phytopharmaceutiques et adjuvants qui ne bénéficient pas de l’autorisation ou du permis prévus par les articles R. 253-5 et R. 253-23, les agents mentionnés à l’article L. 250-2 peuvent, avant d’ordonner le retrait ou la destruction de ces produits, prélever, dans les conditions prévues aux articles R. 253-49 à R. 253-52, des échantillons de ceux-ci.
« Ces agents peuvent ordonner au détenteur qu’il procède à l’inventaire du stock de ces produits et, dans le cas où ceux-ci sont dispersés, qu’il les entrepose, en un même lieu, dans un délai qu’ils fixent.
« Dans l’attente de leur retrait ou de leur destruction, les produits sont consignés et peuvent être mis sous scellés.
« II. – S’il apparaît que des produits ne bénéficiant pas d’une autorisation de mise sur le marché ont été cédés, les agents procédant au contrôle peuvent ordonner leur rappel dans un délai qu’ils fixent.
« Le cédant est, dans ce cas, tenu de fournir à ces agents des informations relatives notamment aux dates de cession des produits, aux quantités de produits cédés, aux nom et adresse du cessionnaire ainsi qu’aux dates de retour et quantités de produits retournés. Le contenu de ces informations est défini par arrêté du ministre chargé de l’agriculture.
« Art. R. 253-54. − S’il apparaît, lors des contrôles et inspections, que des produits végétaux ou d’origine végétale ont été traités avec des produits phytopharmaceutiques ne bénéficiant pas d’une autorisation de mise sur le marché ou d’un permis de commerce parallèle, ces produits végétaux ou d’origine végétale sont consignés et font l’objet de prélèvements d’échantillons, dans les conditions prévues aux articles R. 253-49 à R. 253-52, en vue de contrôler leur teneur en résidus.
« Lorsque l’analyse des échantillons fait apparaître que leur teneur en résidus est supérieure à la limite maximale autorisée par la réglementation applicable, ces produits végétaux ou d’origine végétale demeurent consignés aussi longtemps que cette teneur reste supérieure aux normes admises.
« Si cet objectif ne peut être atteint, les agents mentionnés au I de l’article L. 250-2 ordonnent la destruction des produits végétaux ou d’origine végétale dont il s’agit dans un délai qu’ils fixent et, si nécessaire, en leur présence.
« Section 9
Cette section ne comprend pas de dispositions réglementaires. »
« Section 10 : Dispositions diverses
« Art. D. 253-55. − La commission des produits phytopharmaceutiques, des matières fertilisantes et des supports de culture est chargée :
« 1° De proposer au ministre chargé de l’agriculture toutes les mesures susceptibles de contribuer à la définition et à la normalisation des conditions d’emploi des produits mentionnés à l’article L. 253-1 et à l’article L. 255-1, eu égard à leur degré d’efficacité et à leurs effets indésirables de tous ordres, notamment écologiques et sanitaires ;
« 2° De donner son avis sur toutes les questions que lui soumettent les ministres intéressés et de formuler toutes recommandations relevant de sa compétence et concernant les produits mentionnés aux articles L. 253-1 et L. 255-1.
« Cette commission comprend notamment :
« 1° Des représentants des services publics ;
« 2° Des représentants des organismes professionnels intéressés ;
« 3° Des représentants des organisations agréées de consommateurs ;
« 4° Des représentants d’associations de protection de l’environnement agréées au niveau national conformément aux dispositions de l’article L. 141-1 du code de l’environnement ;
« 5° Des représentants des organisations syndicales de salariés les plus représentatifs du secteur ;
« 6° Des personnalités qualifiées désignées.
« Un arrêté conjoint des ministres chargés de l’agriculture, de la santé, de la consommation, de l’industrie et de l’environnement fixe la composition et les modalités de fonctionnement de la commission. »
Article 2 du décret du 9 mai 2012
L’article R. 254-20 du chapitre IV du titre V du livre II du code rural et de la pêche maritime est complété par un alinéa ainsi rédigé :
« Les dispositions du présent article ne s’appliquent pas aux produits phytopharmaceutiques visés par un arrêté de lutte obligatoire contre les organismes nuisibles pris en application de l’article L. 251-8. »
Article 3 du décret du 9 mai 2012
I. A l’article R. 521-3 du code de l’environnement, la référence à l’article R. 253-85 est remplacée par une référence à l’article D. 253-55.
II. Le chapitre III du titre III du livre V du code de l’environnement (partie réglementaire) est ainsi modifié :
1° A l’article R. 533-24, la référence à l’article R. 253-24 est remplacée par une référence à l’article R. 253-5 ;
2° A l’article R. 533-51, la référence aux articles R. 253-56 à R. 253-59 est remplacée par une référence aux articles D. 253-18 à D. 253-21.
III. Le chapitre Ier du titre Ier du livre IV de la quatrième partie du code du travail (partie réglementaire) est ainsi modifié :
1° A l’article R. 4411-44, les mots : « au sens de l’article L. 253-1 du code rural et de la pêche maritime » sont remplacés par les mots : « définis au 1 de l’article 2 du règlement (CE) n° 1107/2009 » ;
2° A l’article R. 4411-74, les mots : « mentionnés à l’article R. 253-1 du code rural et de la pêche maritime » sont remplacés par les mots : « définis au 1 de l’article 2 du règlement (CE) n° 1107/2009 ».
IV. Aux articles R. 1341-10 et R. 1342-20 du code de la santé publique, les mots : « antiparasitaires à usage agricole définis à l’article L. 253-1 du code rural et de la pêche maritime » sont remplacés par les mots : « phytopharmaceutiques définis au 1 de l’article 2 du règlement (CE) n° 1107/2009 ».
V. Au b du 1° du I de l’article 3 du décret n° 1325-2011 du 18 octobre 2011 fixant les conditions de délivrance, de renouvellement, de suspension et de retrait des agréments des entreprises et des certificats individuels pour la mise en vente, la distribution à titre gratuit, l’application et le conseil à l’utilisation des produits phytopharmaceutiques, les mots : « de la justification » sont supprimés et, au b du 1° du II de cet article, le mot : « conseil » est remplacé par le mot : « vente ».
Article 4 du décret du 9 mai 2012
I. Les autorisations de mise sur le marché en vigueur à la date d’entrée en vigueur du présent décret restent valables jusqu’à leur renouvellement réalisé selon les dispositions du présent décret.
II. Lorsque les modalités visées au 2 de l’article 43 du règlement (CE) n° 1107/2009 relatives au renouvellement des produits phytopharmaceutiques ne sont pas applicables, les autorisations de mise sur le marché de produits phytopharmaceutiques arrivant à échéance font l’objet d’une demande de renouvellement déposée à l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail au plus tard six mois avant cette date d’échéance.
Ces autorisations de mise sur le marché sont prolongées pendant la période nécessaire à la vérification du respect des conditions de renouvellement de l’autorisation.
Ces autorisations sont renouvelées pour la durée prévue par l’article 32 du règlement (CE) n° 1107/2009 si les conditions requises pour le renouvellement sont satisfaites.
III. Lorsque les modalités visées au 2 l’article 43 du règlement (CE) n° 1107/2009 relatives au renouvellement des produits phytopharmaceutiques ne sont pas applicables, les autorisations de mise sur le marché de produits phytopharmaceutiques soumises au réexamen national suite à la première approbation de la ou des substances actives qu’ils contiennent font l’objet d’une demande de réexamen déposée à l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail.
Ces autorisations de mise sur le marché sont prolongées pendant la période nécessaire à la vérification du respect des conditions du réexamen national.
Les nouvelles autorisations délivrées pour ces produits suite à leur réexamen sont valables pour la durée prévue par l’article 32 du règlement (CE) n° 1107/2009 si les conditions requises pour le réexamen sont satisfaites.
IV. Les autorisations de mise sur le marché des produits phytopharmaceutiques en vigueur à la date d’entrée en vigueur du présent décret sont mises en conformité avec le dispositif des deux gammes d’usages définies à l’article D. 253-8 du code rural et de la pêche maritime au moment de leur renouvellement et, au plus tard, au 31 décembre 2016. Les demandes de mise en conformité sont déposées au plus tard au 31 décembre 2015 dans les conditions fixées par arrêté du ministre chargé de l’agriculture.
V. Les autorisations de mise sur le marché à titre d’introduction parallèle et les autorisations de distribution pour expérimentation délivrées avant l’entrée en vigueur du présent décret valent respectivement permis de commerce parallèle et permis d’expérimentation.
Article 5 du décret du 9 mai 2012
Le décret du 11 mai 1937 pris pour l’application de la loi du 4 août 1903, modifiée par la loi du 10 mars 1935, concernant la répression des fraudes dans le commerce des produits utilisés pour la destruction des ravageurs des cultures est abrogé.
Article 6 du décret du 9 mai 2012
I. La section 2 du titre II de l’annexe du décret du 19 décembre 1997 susvisé est ainsi modifiée :
1° Les dispositions relatives aux autorisations de mise sur le marché et autorisations de distribution pour expérimentation des produits phytopharmaceutiques, aux agréments pour la réalisation d’essais officiellement reconnus des produits phytopharmaceutiques, aux refus de transmission d’un dossier de demande d’inscription sur la liste communautaire d’une substance active contenue dans un produit phytopharmaceutique ne se trouvant pas sur le marché au 25 juillet 1993, aux autorisations d’une extension d’usage d’un produit phytopharmaceutique autorisé, aux autorisations provisoires pour la mise sur le marché d’un produit phytopharmaceutique contenant une substance active non inscrite sur la liste des substances inscrites sur la liste des substances actives et n’étant pas sur le marché au 25 juillet 1993, aux autorisations de mise sur le marché des produits phytopharmaceutiques n’excédant pas cent vingt jours et aux autorisations de mise sur le marché des produits phytopharmaceutiques en provenance de l’espace économique européen sont abrogées ;
2° Dans les dispositions relatives aux autorisations d’utilisation, de dissémination et de mise sur le marché des organismes génétiquement modifiés, les références aux articles R.* 253-24, R.* 253-27, R.* 253-32, R.* 253-56 et R.* 253-59 sont supprimées ;
3° Il est ajouté un alinéa ainsi rédigé :
II. Dans l’intitulé du décret n° 97-1203 du 24 décembre 1997, les mots : « ministre de l’agriculture et de la pêche de l’article 2 (2°) » sont remplacés par les mots : « ministre chargé de l’agriculture et des pêches maritimes du second alinéa de l’article 2 ».
III. L’annexe II du décret n° 97-1203 du 24 décembre 1997 susvisé est complétée par l’alinéa suivant :
Article 7 du décret du 9 mai 2012
I. Les dispositions du présent décret s’appliquent aux demandes présentées à compter du 1er juillet 2012.
II. L’article R. 253-37 inséré dans le code rural et de la pêche maritime par le présent décret entre en vigueur le 1er janvier 2013.
Article 8 du décret du 9 mai 2012
Le ministre de l’économie, des finances et de l’industrie, le ministre du travail, de l’emploi et de la santé et le ministre de l’agriculture, de l’alimentation, de la pêche, de la ruralité et de l’aménagement du territoire sont chargés, chacun en ce qui le concerne, de l’exécution du présent décret, qui sera publié au Journal officiel de la République française.
Fait le 9 mai 2012.
François Fillon
Par le Premier ministre, ministre de l’écologie, du développement durable, des transports et du logement : Le ministre de l’agriculture, de l’alimentation, de la pêche, de la ruralité et de l’aménagement du territoire,
Bruno le Maire
Le ministre de l’économie, des finances et de l’industrie,
François Baroin
Le ministre du travail, de l’emploi et de la santé,
Xavier Bertrand